Nickel, Ni, numéro atomique 28
Prix, occurrence, extraction et utilisation du nickel
Le nickel est un élément chimique avec le symbole de l'élément Ni et le numéro atomique 28. Il fait partie des métaux de transition. Dans le tableau périodique, il se trouve après l’ancienne méthode de comptage du 8. Sous-groupe ou groupe fer-platine, selon le plus récent dans le groupe 10 ou groupe nickel.
Histoire
Le nickel a d'abord été représenté uniquement par Axel Frederic Cronstedt 1751 et tire son nom du cupronickel minéral (kopparnickel suédois, aujourd'hui Nickelin) dans lequel il a trouvé le métal jusqu'alors inconnu.
Les mineurs médiévaux utilisaient le terme cupronickel pour désigner le minerai, qui ressemblait à du minerai de cuivre, mais à partir duquel aucun cuivre ne pouvait être obtenu, comme s'il était ensorcelé par un esprit des montagnes ("nickel"). Une étymologie similaire à celle de kobold peut être trouvée dans Cobalt.
La première pièce de monnaie en nickel pur a été appelée 1881.
Occurrence
Le nickel se trouve dans la croûte terrestre avec une teneur d'environ 0,008%. Les preuves géophysiques et géochimiques suggèrent que la majeure partie du nickel est située sur la Terre et sur d’autres planètes terrestres dans le noyau, où il forme un alliage avec du fer et certains éléments légers. Dans le noyau terrestre, sa fraction de masse selon les derniers modèles est d'environ 5,2%.
Solide, c'est-à-dire que le nickel est rare. Jusqu'à présent, seuls les emplacements 50 pour le nickel solide documentés (2018), notamment en Australie, en Chine, au Canada, aux États-Unis d'Amérique et en Russie.
Traditionnellement, la majeure partie de la production de nickel provient de minerais sulfurés tels que la pentlandite (environ 34% de nickel), le gravier magnétique de nickel (pyrrhotine et agglomérat de pentandite) et certains autres minéraux contenant du nickel tels que la millérite (environ 64-65% de nickel) et le nickelin (environ 44%) Nickel) a gagné. En outre, des minerais de nickel latéritiques, provenant principalement de Garnierit, mélange de Népouit (environ 46% nickel) et de Willemseit (environ 29% nickel), sont extraits comme matières premières pour la production de nickel. Dans l’ensemble, certains minéraux de nickel 200 sont connus à ce jour et certains ont des teneurs en nickel bien plus élevées que celles déjà mentionnées, mais elles sont beaucoup moins communes que celles-ci. Par exemple, la très rare bunsénite est le minéral avec la teneur en nickel la plus élevée allant jusqu'à 78,58%. Les minéraux tout aussi rares Heazlewoodite et Awaruit contiennent entre 72 et 73% nickel.
L'extraction est en train de changer en raison de l'exploitation des gisements sulfidiques classiques de plus en plus en minerais de nickel latéritiques. Cependant, ils doivent être obtenus péniblement par lixiviation acide à haute pression (lixiviation anglaise à haute pression).
Pour pouvoir dégrader le nickel de manière économique, la teneur en nickel du minerai doit être d'au moins 0,5%. Les occurrences les plus importantes se trouvent au Canada (bassin de Sudbury), en Nouvelle-Calédonie, en Russie (Norilsk et Kola Peninsula), en Australie (Queensland) et à Cuba (Moa Bay et Nicaro). Le cobalt est un compagnon courant du nickel.
Nickel comme minéral

Le nickel naturel sous sa forme élémentaire a été décrit pour la première fois par Paul Ramdohr 1967 et reconnu par l'Association minéralogique internationale (IMA) comme une espèce minérale indépendante (numéro d'entrée interne de l'IMA: 1966-039).
Selon la classification des minéraux selon Strunz (édition 9), le nickel sous le système no. 1.AA.05 (Éléments - Métaux et composés intermétalliques - Famille de la cupalite de cuivre - Groupe du cuivre) respectivement dans le produit obsolète 8. Edition répertoriée sous I / A.04b (série nickel). La classification des minéraux selon Dana, qui est principalement utilisée dans les pays anglophones, mène l’élément minéral dans le système no. 01.01.11.05 (groupe fer-nickel).
Le type de localité est la péninsule de Bogota, près de Canala, dans la province septentrionale de la Nouvelle-Calédonie, où du nickel natif se présente sous la forme de grains cubiques idiomorphes ou de cubes incarnés jusqu’à environ 0,1 mm sous forme d’inclusions dans Heazlewoodite et de "spidery", masse irrégulière entre les Heazlewooditkörnern. Les minéraux d'accompagnement en plus de la Heazlewoodite comprennent la chalcopyrite, la chalcocite, la galène, Godlevskit, le cuivre solide, la millérite, l'orcelite, la pentlandite, la pyrite et la pyrrhotite.
Extraction et présentation
La majeure partie du nickel provient de minerais de fer contenant du nickel et du cuivre, tels que du gravier magnétique de nickel. Pour que l'extraction soit rentable, le nickel doit d'abord être enrichi par flottation à une teneur en nickel d'environ cinq pour cent. Ensuite, le minerai est torréfié de manière similaire à la production de cuivre. Ici, le minerai est d'abord pré-grillé pour convertir une partie du sulfure de fer en oxyde de fer. Ensuite, les silicates et le coke sont ajoutés à l’oxyde de fer sous forme de laitier sous forme de silicate de fer. En même temps, la pierre brute en cuivre-nickel est formée de nickel, de cuivre et de sulfure de fer. Comme il est plus lourd que le laitier au silicate de fer, les deux phases peuvent être exploitées séparément.
Ensuite, la pierre brute est remplie dans un convertisseur et de la silice est ajoutée. Il est injecté avec de l'oxygène. En conséquence, le sulfure de fer restant est rôti en oxyde de fer puis lavé. Le résultat est la pierre fine en cuivre-nickel, qui comprend environ 80% de cuivre et de nickel et environ 20% de soufre.
| Classement | Transport routier | Production (en millions de t) |
|---|---|---|
| 1 | Indonésie | 400.000 |
| 2 | Philippines | 230.000 |
| 3 | Neukaledonien | 210.000 |
| 4 | Canada | 210.000 |
| 5 | Australie | 190.000 |
| 6 | Russie | 180.000 |
| 7 | Brésil | 140.000 |
| 8 | République populaire de Chine | 98.000 |
| 9 | Guatemala | 68.000 |
| 10 | Kuba | 51.000 |
Extraction de Rohnickel
Pour récupérer les Rohnickels, le nickel doit être séparé du cuivre. À cette fin, la pierre fine est fusionnée avec du sulfure de sodium Na2S. Seul un léger double sulfure fondant se forme entre le sulfure de cuivre et le sulfure de sodium. Deux phases faciles à séparer de sulfure double de cuivre-sodium (liquide) et de sulfure de nickel sont formées. Après la séparation, le sulfure de nickel est torréfié en oxyde de nickel puis réduit en nickel avec du coke.
Pour récupérer le nickel pur, le Rohnickel est raffiné par électrolyse. À cette fin, le Rohnickel est connecté en tant qu’anode, le Nickelelfeinblech en tant que cathode dans une cellule électrolytique. L'électrolyte utilisé est une solution de sel de nickel. Pendant l'électrolyse, le nickel et tous les composants moins nobles entrent en solution à l'anode. Tous les composants plus nobles restent solides et tombent sous l'électrode sous forme de boue d'anode. Cela constitue une source importante pour la production de métaux précieux, tels que l'or ou le platine. À la cathode, les ions de nickel de la solution sont réduits en nickel, tous les composants les moins nobles restant en solution. La pureté du nickel électrolytique est d’environ 99,9%.
Pour l'extraction du nickel pur avec une pureté de 99,99%, il existe un processus spécial, le processus de la lune, du nom de Ludwig Moon, qui a découvert le nickel tétracarbonyle 1890. Ce processus repose sur la formation et la décomposition du nickel tétracarbonyle. À cette fin, la poudre de Rohnickel finement divisée est amenée dans un courant de monoxyde de carbone à 80 ° C. Cela forme du nickel tétracarbonyle gazeux. Celui-ci est débarrassé de la poussière de combustion et envoyé dans une chambre de décomposition chaude 180 ° C. A l'intérieur se trouvent de petites billes de nickel. À ce stade, le nickel tétracarbonyle se décompose à nouveau en nickel et en monoxyde de carbone. Cela donne du nickel très pur.
Représentation du travail
Il existe différentes méthodes pour représenter de petites quantités de nickel très pur en laboratoire:
Réduction de l'oxyde avec de l'hydrogène à 150 ° C à 250 ° C:
Réduction d'une suspension de chlorure de nickel (II) dans de l'éther diéthylique par une réaction de Grignard
Décomposition thermique de l'oxalate de nickel (II) en l'absence d'oxygène:
Réduction du chlorure de nickel (II) avec une dispersion de sodium:
En particulier, la thermolyse de l'oxalate fournit une poudre de nickel pyrophorique finement divisée.
Propriétés
Propriétés physiques
Le nickel est un métal blanc argenté qui fait partie des métaux lourds ayant une densité de 8,91 g / cm3. Il est moyennement dur (dureté Mohs 3,8), forgeable, ductile et peut être poli très bien. Le nickel, comme le fer et le cobalt, est ferromagnétique, avec une température de Curie de 354 ° C. Le métal cristallise dans une structure cristalline à faces cubiques (type cuivre) dans le groupe d'espace Fm3m (numéro de groupe d'espace 225) avec le paramètre de réseau a = 352,4 pm ainsi que dans quatre unités de formule par cellule. Cette structure le conserve même à des pressions élevées allant au moins jusqu’à 70 GPa. Une autre modification métastable avec garnissage sphérique centré sur le corps cubique pourrait être obtenue en couches minces sur de l'arséniure de fer ou de gallium. Il a une température de Curie significativement plus basse avec 183 ° C.
La résistance à la traction du nickel recuit dans 400-450 MPa est à un allongement à la rupture entre 30 et 45%. Les valeurs de dureté se situent autour du 80 HB. Le nickel renforcé à froid dont l’allongement à la rupture est inférieur à 2% atteint des résistances jusqu’à 750 MPa avec des valeurs de dureté proches de 180 HB. Les produits semi-finis en nickel pur avec une teneur en 99% Ni peuvent être renforcés à froid.
L'isotope 62Ni possède l'énergie de liaison la plus élevée par nucléon de tous les isotopes de tous les éléments.
Propriétés chimiques
Le nickel est très stable à la température ambiante dans l'air, l'eau, l'acide chlorhydrique et les alcalis. Les acides dilués n'attaquent le nickel que très lentement. Par rapport aux acides oxydants concentrés (acide nitrique), la passivation est analogue à l’acier inoxydable. Le nickel est soluble dans l'acide nitrique dilué (environ 10 pour cent 15 pour cent). Même un acide nitrique semi-concentré (environ 30 pour cent) provoque une passivation notable. L'état d'oxydation le plus courant est + II, plus rarement -I, 0, + I, + III et + IV sont observés. Dans le nickel tétracarbonyle, le nickel a le numéro d’oxydation 0. Les sels de nickel (II) se dissolvent dans l'eau pour former des complexes aquatiques de couleur verdâtre.
Le nickel finement divisé réagit avec le monoxyde de carbone de 50 à 80 ° C pour former du nickel tétracarbonyle, Ni (CO) 4, un liquide incolore et très toxique. Cela sert d'intermédiaire pour la production de nickel pur par le processus de la lune. De 180 à 200 ° C, le nickel tétracarbonyle se décompose en nickel et en monoxyde de carbone.
Physiologie
L'essentialité controversée du nickel contraste avec l'existence de plusieurs enzymes qui contiennent normalement du nickel, mais n'en dépendent pas, car son rôle en tant que cation peut être repris par d'autres cations divalents. Chez l'homme, ce sont trois protéines connues pour se lier au nickel:
L'alpha-fœtoprotéine lie le nickel, mais n'en dépend pas, car il n'y a pas d'enzyme
Acéductone dioxygénase, une enzyme de la voie de récupération de la méthionine qui se lie généralement au nickel ou à un autre cation divalent
Polyribonucléotide 5'-hydroxyl kinase Clp1, qui nécessite comme cofacteur le magnésium, le manganèse ou le nickel
Pour les plantes et divers micro-organismes, le nickel est essentiel pour l'isolement de plusieurs enzymes (p. Ex. L'uréase, Co-F430) dans le centre actif, ainsi que pour la détection de carences dans des environnements pauvres en nickel, renforcées par l'ajout de Ni (II). ) Sels sécurisés.
En électrophysiologie, les ions nickel sont utilisés pour bloquer les canaux calciques activés par la tension.
Problèmes de santé
Le nickel est la cause la plus courante d'allergie de contact avec la dermatite au nickel: en Allemagne, on estime qu'un 1,9 sur un million de personnes sont sensibilisées au nickel. De ce fait, les métaux et alliages en contact avec la peau sont de moins en moins nickelés. Environ 4,5% de tous les enfants sont sensibilisés au nickel. Lors d'un contact renouvelé avec l'allergène, ils peuvent réagir avec une allergie de contact.
Selon l'Autorité européenne de sécurité des aliments (EFSA), la dose journalière tolérable (DJT) du nickel est de 2,8 microgrammes (0.0028 milligrammes) par kilo de poids corporel. 2019 a demandé à la Chambre de travail de Haute-Autriche de examiner douze boissons au soja différentes à l'Agence pour la santé et la sécurité alimentaire. Les valeurs se situaient entre 0,25 (boisson au soja Dennree Nature) et 0,69 milligrammes par litre (oui, bien sûr, boisson au soja biologique). Dans le lait de soja à haute teneur en calories, un kilo d’enfants lourds 30 a déjà consommé plus de deux fois plus de nickel par quart de litre, comme le recommande l’EFSA.
L'inhalation de composés inorganiques de nickel est associée à un risque accru de cancer du carcinome épidermoïde des poumons et des voies respiratoires supérieures. En Allemagne, ces néoplasmes malins sont reconnus comme maladies professionnelles sur exposition professionnelle (BK 4109). En outre, l'augmentation de la teneur en nickel dans l'air et dans l'eau de boisson constitue un facteur de risque de sensibilisation au nickel chez les enfants.
L'utilisation de nickel dans les produits de consommation (tels que les montres-bracelets, les jouets, les équipements de traitement des aliments, etc.) est limitée par la réglementation en vigueur dans l'Union européenne.
Utiliser
Le nickel est nécessaire en tant que métal en petites quantités, la majeure partie de la production est destinée à la production d’aciers inoxydables et d’alliages de nickel. Le nickel est utilisé dans de nombreux biens industriels et de consommation spécifiques et identifiables, notamment l'acier inoxydable, les aimants Alnico, les pièces de monnaie, les piles rechargeables, les cordes de guitare électrique, les capsules de microphone, le placage sur les appareils de plomberie et les alliages spéciaux tels que Permalloy, Elinvar et Invar. Il est utilisé pour le revêtement et comme teinte dans le verre. Les réserves de gisements de nickel épuisées du point de vue actuel se situent entre 70 et 170 millions de tonnes. Actuellement, plus d'un million de tonnes (2006: 1,340 millions de tonnes) sont produites chaque année dans le monde. Le prix du nickel est parfois soumis à de très fortes fluctuations de prix en raison de la spéculation sur les marchés financiers.
Près de 25, le gisement mondial de nickel se trouve en Nouvelle-Calédonie, un territoire français d'outre-mer.

Batterie nickel-cadmium, image Wikipedia
Utiliser comme métal
Du nickel métal pur est utilisé sous forme finement divisée en tant que catalyseur dans l'hydrogénation des acides gras insaturés. En raison de sa résistance chimique, le nickel est utilisé dans les appareils de laboratoire chimique et dans l'industrie chimique (creusets en nickel pour les digestions, par exemple). En alliages de nickel métal nickel, z. Pour les pièces.

Fil de nickel (fil), fil de nickel peut être tiré jusqu'à 0,01mm mince
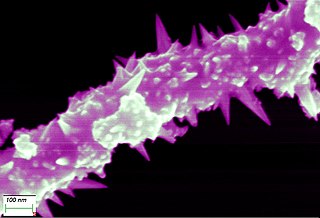
Le fil de nickel 0,01mm dans la considération par un microscope à haute performance
Le nickel sert de métal de revêtement pour la protection contre la corrosion ("nickelage") d'objets en métal: En raison de ses propriétés de protection contre l'oxydation, les métaux (en particulier le fer) sont revêtus d'une couche de nickel pour certaines applications techniques au moyen de la technologie galvanique.
Le métal était également utilisé auparavant pour fabriquer les montures de lunettes de protection en nickel.
En tant qu'émetteur bêta, l'isotope de nickel 63Ni est utilisé dans les détecteurs à capture d'électrons utilisés dans les chromatographes en phase gazeuse.
Utiliser comme alliage
Le nickel est un métal d'alliage important qui est principalement utilisé pour la finition de l'acier. La majeure partie du nickel y va. Il rend l'acier résistant à la corrosion et augmente sa dureté, sa ténacité et sa ductilité. Les aciers fortement alliés au nickel sont utilisés dans des environnements particulièrement corrosifs. L'acier inoxydable V2A (le nom vient du "test batch 2 austénitique" dans l'aciérie de Krupp, correspond à X12CrNi18-8) contient 8% de nickel en plus de 18% de chrome, V4A (marques Cromargan ou Nirosta) 11% en plus de 18% de chrome et 2% de molybdène.

Pièces de nickel image Wikipedia
Le nickel est un excellent agent d'alliage pour certains métaux précieux et est utilisé dans les essais au feu en tant que collecteur d'éléments du groupe du platine. En tant que tel, le nickel est capable de collecter entièrement les six éléments du groupe du platine, en particulier le platine et le palladium, des minerais et de collecter partiellement de l'or.
La mousse de nickel ou le maillage de nickel sont utilisés dans les électrodes à diffusion gazeuse pour les piles à combustible alcalines.
Le nickel et ses alliages sont souvent utilisés comme catalyseurs pour les réactions d'hydrogénation. Le nickel de Raney, un alliage de nickel-aluminium finement divisé, est une forme courante, bien que des catalyseurs apparentés soient également utilisés, y compris des catalyseurs de type Raney.
Environ 20% du nickel est utilisé (en Allemagne) pour la production d’autres alliages de nickel:
Konstantan, un alliage de 55% cuivre et 45% nickel, qui présente une résistivité électrique pratiquement constante sur une large plage de températures. Il est principalement utilisé pour des résistances précises.
Les superalliages à base de nickel sont des alliages spécialement conçus pour être utilisés à des températures élevées et dans des milieux corrosifs. Ils sont utilisés, par exemple, dans les turbines d'avion et les turbines à gaz de centrales.
Raney nickel, un alliage de nickel-aluminium qui est un catalyseur important pour l'hydrogénation de composés organiques.
Nickel argent, alliage de cuivre-nickel-zinc à teneur en nickel 10-26, particulièrement résistant à la corrosion, principalement utilisé pour la coutellerie et les équipements électrotechniques.
Monel, également un alliage de cuivre-nickel avec environ 65% nickel, 33% cuivre et 2% fer, qui se caractérise par une résistance chimique particulière, notamment le fluor. Il est donc utilisé pour les bouteilles de gaz fluorées.
Fonte ductile austénitique, fonte sphéroïdale spéciale contenant jusqu'à% 20% nickel, destinée à être utilisée dans des environnements corrosifs et à des températures élevées.
preuve
La réaction de détection des sels de nickel (II), généralement solubles dans l'eau de couleur verte, est réalisée par gravimétrie et qualité dans la séparation quantitative avec une solution de diméthylglyoxime (réactif de Tschugajew). Les sels de nickel sont préalablement éventuellement précipités par le sulfure d'ammonium sous forme de sulfure de nickel (II) gris-noir et dissous dans de l'acide nitrique. La détection spécifique est alors possible par réaction avec la diméthylglyoxime en solution ammoniacale. Le bis (diméthylglyoximato) nickel (II) rouge framboise précipite sous forme de complexe:
Étant donné que le nickel est quantitativement précipité dans une solution ammoniacale avec du diméthylglyoxime, cette détection est également utile pour une analyse gravimétrique quantitative du nickel. À partir d’une solution ammoniacale, une détermination quantitative peut également être effectuée par électrogravimétrie sur une électrode à mailles de platine. Semblable à d'autres métaux lourds, le nickel est aujourd'hui généralement déterminé quantitativement par spectroscopie atomique ou spectrométrie de masse dans la région ultra-trace. La voltampérométrie inverse avec accumulation par adsorption du complexe Ni-diméthyglyoxime sur des gouttes de mercure ou un film de mercure suspendues est extrêmement sensible.
Liens
Le nickel est présent dans les composés principalement à l'état d'oxydation + II. Les niveaux 0, + I, + III et + IV sont rares et généralement instables. Le nickel forme une variété de complexes essentiellement colorés.
oxyde
L'oxyde de nickel (II) et l'oxyde de nickel (III) sont des solides verts et noirs, respectivement, et sont utilisés pour fabriquer des céramiques, des verres et des électrodes. De plus, ils sont utilisés comme catalyseurs pour l'hydrogénation de composés organiques. Souvent, comme beaucoup d'autres oxydes de métaux binaires, l'oxyde de nickel (II) n'est pas stoechiométrique, ce qui signifie que le rapport nickel-oxygène diffère de 1: 1. Cette propriété s'accompagne d'un changement de couleur dans lequel l'oxyde de nickel (II) stoechiométriquement correct est le vert et l'oxyde de nickel (II) non stoechiométrique est le noir. L'oxyde de nickel (III) a un puissant effet oxydant et est inconnu en tant que substance pure.
des halogénures
Le chlorure de nickel (II) est un solide jaune très hygroscopique qui sert de colorant pour la céramique et pour la production de catalyseurs au nickel. Outre la forme anhydre, il reste encore des chlorures de nickel (II) hydratés, z. Sous forme de chlorure de nickel (II) vert hexahydraté, qui s'est cristallisé à partir de solutions aqueuses de chlorure de nickel. Le chlorure de nickel (II) anhydre a une structure cristalline trigonale de type chlorure de cadmium (II) ayant le groupe spatial R3m (numéro de groupe spatial 166). L'hexahydrate cristallise dans le système cristallin monoclinique du groupe spatial C2 / m (groupe spatial N ° 12).
Le fluorure de nickel (II) est également très hygroscopique et forme des cristaux tétragonaux jaunâtres à verts. Contrairement à beaucoup de fluorures, il est stable dans l'air. Il se cristallise dans le système cristallin tétragonal avec le groupe d'espace P42 / mnm (numéro de groupe d'espace 136). Le tétrahydrate cristallise dans le système cristallin orthorhombique avec le groupe spatial P21ab (numéro de groupe spatial 29, position 3).
Autres composés inorganiques du nickel
L'hydroxyde de nickel (II) et l'hydroxyde d'oxyde de nickel (III) sont utilisés pour stocker de l'énergie électrique dans des accumulateurs au nickel-cadmium et autres.
Le nitrate de nickel (II) est utilisé dans l’industrie céramique comme pigment brun, en teinture en tant que mordant, pour le nickelage électrolytique, pour la récupération de l’oxyde de nickel (II) et pour la production de nickel catalytique pur. Le nitrate de nickel (II) est un oxydant puissant qui se présente généralement sous la forme de son hexahydrate Ni (NO3) 2 · 6 H2O.
Le sulfate de nickel (II) et le sulfate d'ammonium et de nickel (II) sont utilisés pour le placage (placage au nickel). Le sulfate de nickel (II) est le composé de nickel le plus important sur le plan technique. Il est utilisé pour la production d'autres composés et catalyseurs à base de nickel. Les solutions aqueuses de sulfate de nickel (II) et de chlorure de nickel (II) sont utilisées pour l’électrodéposition de couches de nickel métallique. En outre, il est utilisé dans la teinture en tant que mordant et dans la production de masques à gaz.
Le carbonate de nickel (II) se présente sous plusieurs formes d'hydrates. Il est utilisé comme catalyseur dans le durcissement des graisses et dans la production d’oxydes de nickel (II), de peintures céramiques (pigments) et de glaçures, ainsi que dans la galvanoplastie. Il a formé un système cristallin trigonal avec le groupe d'espace R3c (numéro de groupe d'espace 161).
Le sulfure de nickel (II) précipite à partir de solutions ammoniacales, mais non acides, contenant du nickel avec du sulfure d'ammonium. En conséquence, le nickel peut être séparé avec le groupe sulfure d'ammonium dans le processus de séparation des cations.
L'antimonide de nickel est un minéral métallique brillant et a une couleur rouge cuivrée brillante. L'antimoine au nickel est utilisé comme matériau dans les plaques à champ magnétique où il est inséré entre des couches magnétiquement sensibles d'antimoniure d'indium. Les plaques de champ magnétique modifient leur résistance électrique en fonction de la densité de flux magnétique et servent de capteur pour les champs magnétiques. Il forme une structure cristalline hexagonale dans le groupe d'espace P63 / mmc (numéro de groupe d'espace 194).
Composés organiques de nickel
Le nickel tétracarbonyl Ni (CO) 4 est un liquide incolore et très toxique. C'est un intermédiaire important dans le processus lunaire. Le nickel tétracarbonyle a été le premier composé métallique carbonyle découvert.
les complexes de nickel
Les ions nickel et en particulier nickel (II) forment de nombreux complexes, pour la plupart colorés. Les numéros de coordination 6, 5 ou 4 sont les plus courants. Dans le cas de ligands monodentés faibles, par exemple l'eau, ils sont généralement présents sous forme de complexes octaédriques et paramagnétiques à haut spin avec le numéro de coordination 6. Des ligands forts tels que le cyanure forment des complexes diamagnétiques à faible spin, plans carrés. Le diméthylglyoxime forme également un complexe plan carré, car le complexe est en outre stabilisé par des liaisons hydrogène. Ce dernier complexe de bis (diméthylglyoximato) nickel (II) est important pour la détection chimique humide du nickel. Les complexes de nickel anionique se terminent par "-niccolate".
Des exemples de complexes d'amines sont les complexes bleu tétraammine nickel (II) et violet hexaammine nickel (II). Les deux composés sont obtenus par addition d'ammoniac à des solutions de sels de nickel (II):
L'ajout de cyanure de potassium à des solutions salines de nickel (II) produit initialement du cyanure de nickel (II), qui se dissout en excès de cyanure de potassium en tétracyanoniccolate de potassium jaune (II):
Un composé correspondant est formé avec du thiocyanate de potassium. Un composé très sensible est l'hexafluoroniccolate de potassium (IV) (K2 [NiF6]). Le tétracyanoniccolate de potassium (II) peut être préparé à partir de nickel monovalent en utilisant un agent réducteur puissant K4 [Ni2 (CN) 6]. De plus, il existe une variété de complexes avec des ligands organiques tels que l'éthylènediamine ou des anions d'acides carboxyliques.


![{\ displaystyle {\ ce {NiC2O4 -> [T] [] Ni + 2 CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4f5ac7119d30ce593cf99675097e91e39e33a04d)


![{\ displaystyle {\ ce {NiSO4 + 4NH4 + + 4OH- -> [Ni (NH3) 4] SO4 + 4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fed711e628c3ba92046eb178a459488074a035c9)
![{\ displaystyle {\ ce {Ni (CN) 2 + 2KCN -> K2 [Ni (CN) 4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a2b8181f20f5d9ad99c2900689b699739283d0d)
