Cadmium, cd, numéro atomique 48
Prix du cadmium, historique, occurrence, extraction et utilisation
Le cadmium (également rarement le cadmium, le grec καδμία kadmía, latin cadmea, «terre de zinc oxydée ou carbonatée») est un élément chimique avec le symbole de l'élément Cd et le numéro atomique 48. Il est généralement compté parmi les métaux de transition, bien qu’il présente une coquille fermée d et qu’il ressemble donc davantage aux éléments principaux du groupe, en particulier les métaux alcalino-terreux. Dans le tableau périodique, il est dans le 5. Période ainsi que le 2. Sous-groupe (groupe 12) ou groupe de zinc.
Histoire
1817 a découvert de manière indépendante du cadmium dans du carbonate de zinc contaminé par Friedrich Stromeyer et Carl Samuel Hermann. Stromeyer a remarqué que le carbonate de zinc contaminé se décolorait en chauffant - un comportement qui ne montrait pas de carbonate de zinc pur. Pendant près de 100 années, le métal n'a été gagné qu'en Allemagne.
Pline l'Ancien a relaté dans son histoire naturelle autour de l'année 77 Naturalis historia de Galmeifunden en Allemagne: "cadmea [...] ferunt nuper etiam dans Germania provincia repertum" (en allemand: "a récemment été retrouvé dans la province de Germania Galmei"). Le terme cadmium était déjà utilisé au Moyen Âge, probablement pour le zinc ou son minerai de carbonate. Comme en témoigne un document publié par l’empereur Frédéric II en avril 1226 à Ravenne, celui-ci confère le droit au monastère bénédictin de Saint-Paul à Lavanttal "Cadmiae tam argentj quam plumbi et ferri, que dans le territoire ipsius monasteri de cetero inveniri contint "ad opus suum" (en allemand: "que le zinc, ainsi que l'argent, ainsi que le plomb et le fer, qui se trouvent dans la zone du monastère, sont utilisés à cette fin").
En dépit de la toxicité du cadmium et de ses composés, le British Pharmaceutical Codex de 1907 utilise l’iodure de cadmium comme traitement des glandes scrofuleuses et des glandes blanchisseuses.
1907 a défini l'Ångström comme étant 1 / 6438,4696 multiplié par la longueur d'onde d'une raie spectrale rouge de cadmium dans l'air sec avec une teneur en dioxyde de carbone de 0,03% à une température de 15 ° C et une pression de 1 atm. La Conférence générale 1960 sur les poids et mesures a accepté la longueur d'onde multipliée par XN d'une raie spectrale rouge de cadmium comme définition secondaire d'un mètre.
1942 a utilisé des feuilles de cadmium Enrico Fermi dans le premier réacteur nucléaire au monde. Les feuilles pourraient être poussées dans et hors du réacteur pour contrôler la réaction en chaîne. Le cadmium peut capturer les neutrons de gap modérés et influer ainsi sur la criticité du réacteur.
Occurrence
Le cadmium est un élément très rare. Sa part dans la croûte terrestre n'est que d'environ 3 · 10-5 . Le cadmium est extrêmement rare sous sa forme naturelle, c'est-à-dire sous sa forme élémentaire. Jusqu'à présent, seuls cinq sites dans trois pays sont connus: la rivière Khann'ya dans le bassin de Vilyui, le bassin de la rivière Jana près de Verkhoyansk et l'intrusion de Billeekh dans la République russe de Sakha (Yakoutie, Sibérie orientale); les fosses Goldstrike près de Lynn dans le comté d'Eureka dans l'État américain du Nevada et le massif de Burabaiskii dans la région d'Aqumola au Kazakhstan.
Les minerais contenant du cadmium sont principalement l’écran de cadmium Greenockit (CdS) jusqu’à 77,81% Cd et le Cadmiumspat Otavit (CdCO3) jusqu’à 65,20% Cd, mais ils sont trop rares pour une dégradation commerciale. Les deux sont presque toujours associés à divers minerais de zinc tels que la sphalérite (ZnS) et la smithsonite (ZnCO3).
Au total (stand 2018), on sait quelque chose de plus que les minéraux 20 cadmium. Le très rare oxyde de cadmium Monteponite a la plus haute teneur en Cd, jusqu’à 87,54%. Hawleyit (77,81% Cd), la cadmosélite (58,74% Cd) et Drobecit (IMA 2002-034, 40,07% Cd) sont d’autres minéraux.
Le cadmium en tant que minéral
Le cadmium d'origine naturelle sous sa forme élémentaire a été décrit pour la première fois par 1979 BV Oleinikov, AV Okrugin et NV Leskova. et reconnu par l'Association minéralogique internationale (IMA) en tant qu'espèce minérale indépendante (numéro d'accession interne IMA: 1980-086a).
Selon la classification des minéraux selon Strunz (édition 9), le cadmium est sous le système no. 1.AB.05 (Éléments - Métaux et intermétalliques - Famille zinc-laiton - Groupe du zinc). Dans le 8 obsolète. Cependant, le cadmium n'est pas encore répertorié dans l'édition de la Systématique minérale de Strunz. Seul le dernier répertoire de Lapis mis à jour par 2018, basé sur cette forme de numérotation des systèmes par considération pour les collectionneurs privés et les collections institutionnelles, a reçu le système et le n ° de minerai. I / A.4-40. La classification des minéraux selon Dana, qui est principalement utilisée dans les pays anglophones, mène l’élément minéral dans le système no. 01.01.05.02.
Extraction et présentation
Le cadmium est obtenu exclusivement en tant que sous-produit de la fusion du zinc et, dans une moindre mesure, de la fusion du plomb et du cuivre. De plus petites quantités s’appliquent également au recyclage du fer et de l’acier.
La production de cadmium dépend de la façon dont le zinc est extrait. Lors de l'extraction du zinc par voie sèche, le cadmium est d'abord réduit avec le zinc. Parce que le cadmium a un point d'ébullition plus bas que le zinc, il s'évapore plus facilement. En conséquence, un mélange de cadmium et de zinc s'évapore du récipient de réduction et réagit ailleurs avec l'oxygène en oxyde de cadmium et de zinc. Ensuite, ce mélange est mélangé dans une cuve de distillation avec du coke et distillé du cadmium à partir du zinc. La distillation fractionnée permet d'atteindre des niveaux plus élevés de cadmium.
Lors de l'extraction humide du zinc, les ions de cadmium dissous sont réduits et précipités avec de la poussière de zinc. Le cadmium résultant est oxydé avec de l'oxygène en oxyde de cadmium et dissous dans de l'acide sulfurique. À partir de la solution de sulfate de cadmium obtenue, on obtient par électrolyse des anodes en aluminium et des cathodes en plomb, notamment du cadmium électrolytique pur.
Propriétés physiques
Le cadmium est un métal argenté brillant d'une densité de 8,65 g / cm3. Il est souple (dureté Mohs 2), plastiquement déformable et peut également être coupé à l'aide d'un couteau afin de tirer les fils et de le marteler dans les feuillets.
Le cadmium se solidifie exclusivement dans le système cristallin hexagonal du groupe spatial P63 / mmc (numéro de groupe spatial 194). Les paramètres de réseau du cadmium pur sont a = 0,2979 nm (correspond à 2,98 Å) et c = 0,5617 nm (correspond à 5,62 Å) pour les unités de formule 2 par unité de cellule.
Comme pour l'étain, des bruits typiques se produisent lors de la flexion de cadmium de pureté moyenne (appelé étain d'étain dans de l'étain). Le cadmium poli perd sa brillance dans l'air après quelques jours, même s'il est plus résistant à la corrosion que le zinc. Dans l'air gazeux, il forme un revêtement blanc grisâtre contenant du dioxyde de carbone. Fortement chauffé, il brûle avec une flamme rougeâtre à jaune en oxyde de cadmium brunâtre brunâtre.
La haute toxicité de CdO au cours de la Seconde Guerre mondiale a été testée par les États-Unis pour son aptitude à servir d'agent de guerre chimique.
Propriétés chimiques
Dans les composés chimiques, il est généralement divalent. Il est chimiquement similaire au zinc, mais a tendance à former des composés complexes avec le numéro de coordination 4. Dans l'air, le cadmium forme un noircissement de la surface dû à l'oxydation. En milieu alcalin, la surface est insoluble, lourde en acide sulfurique et en acide chlorhydrique et facilement soluble en acide nitrique.
Utiliser
En raison de la forte toxicité du cadmium, son importance diminue. Depuis décembre 2011, il est interdit dans l'Union européenne pour les bijoux, les alliages de soudure et le PVC. Le cadmium est ou a été utilisé:
- comme protection contre la corrosion pour les matériaux ferreux (cadmiage)
- comme revêtement de surface pour les matériaux en aluminium en génie militaire (par exemple, des lance-roquettes)
- pour batteries nickel-cadmium
- pour les pigments de couleur jaune à rouge foncé de sulfure de cadmium et de séléniure de cadmium pour peintures et plastiques (entre-temps peu d’importance pratique en raison des risques possibles pour la santé, en particulier lors de la combustion des articles correspondants)
- en tant que métal d'alliage dans les alliages à bas point de fusion, par exemple les matériaux pour paliers ou le bois de Wood
- plus tôt que le lubrifiant dans les freins à disque
- en tant que composant de matériaux de soudure (brasure), également pour le brasage d'alliages
- pour la production de semi-conducteurs
- Oxyde de cadmium en tant que luminophore dans les tubes de télévision noir et blanc et addition dans les luminophores bleu et vert des tubes de couleur
- Oxyde de cadmium en mélange avec de l'argent dans les contacts de commutation
- en tant que matériau de protection contre les neutrons thermiques et pour les barres de commande en technologie nucléaire en raison de la section transversale particulièrement élevée de l'isotope 113 pour la capture de neutrons
- en tant que source de rayonnement gamma de haute énergie (autour de 7 MeV) provenant de neutrons thermiques pour la génération ultérieure de positrons par génération de paires
- Sulfure de cadmium dans des posemètres dont la sensibilité spectrale est similaire à celle de l'œil humain
- Tellurure de cadmium en tant que capteur sensible à l'infrarouge pour les caméras (matrices plan focal)
- dans les cellules solaires à couche mince telles que le tellurure de cadmium ou le sulfure de cadmium pour la production d'électricité
- Stéarate de Cd en tant que stabilisant dans les plastiques, par exemple dans le PVC (insensible à la lumière, mais entre-temps d'une faible importance pratique en raison des risques possibles pour la santé)
- plus tôt dans les éléments normaux de Weston pour déterminer l’unité de mesure de la tension, les volts 1
- Alliages de bismuth et de cadmium pour les fusibles
- Alliages d'argent-cadmium utilisés comme désoxydant dans la production d'argent sterling
- pour les bijoux: alliages or-vert or-cadmium
- Lampe Cadmium
- lasers hélium-cadmium
- Les ions cadmium bloquent les canaux calciques activés par la tension en électrophysiologie
pour colorer le verre en jaune, orange et rouge en ajoutant du sulfure de cadmium, du séléniure et du tellurure ou leurs mélanges.
Les sulfamides de cadmium (jaune), le séléniure de cadmium (rouge) et le tellurure de cadmium (noir) sont des semi-conducteurs II-VI importants. Ils sont produits, par exemple, sous forme de points quantiques nanoparticulaires et utilisés, entre autres, en biochimie in vitro.
preuve
Le Glühröhrchenprobe peut servir d’échantillon préliminaire de cadmium. À cette fin, une partie de la substance mère est chauffée dans un Glühröhrchen à point de fusion élevé et réduit le mélange sulfure-oxyde résultant avec l’oxalate de sodium en métaux. En tant que composant volatil, le cadmium s’évapore et se dépose en miroir métallique sur la partie supérieure du tube.
En ajoutant ensuite du soufre et en renouvelant le recuit, du sulfure de cadmium se forme à partir du miroir métallique et de la vapeur de soufre, rouge à la chaleur et jaune à la température ambiante. Ce changement de couleur peut être répété plusieurs fois.
La réaction de détection des cations de cadmium est la précipitation avec une solution de sulfure ou de sulfure d'hydrogène-eau sous forme de sulfure de cadmium jaune. D'autres ions de métaux lourds interfèrent avec cette détection, de sorte qu'avant d'effectuer une séparation de cations.
Pour la détermination quantitative des traces de cadmium, la polarographie est recommandée. Les ions cadmium (II) atteignent un niveau dans 1 M KCl à -0,64 V (vs SCE). Dans la gamme des ultra-traces, la voltamétrie inverse peut être utilisée sur des électrodes à mercure. Le tube en graphite AAS du cadmium est également très sensible. Ici, 0,003 μg / l peut encore être détecté. L'élément relativement volatil ne tolère pas une température de pyrolyse élevée. Un modificateur de matrice tel que le nitrate de palladium et de magnésium peut aider.
Sicherheitshinweise
Le cadmium est très toxique et ses composés sont classés comme nocifs (comme le tellurure de cadmium), toxiques (par exemple le sulfure de cadmium) ou très toxiques (oxyde de cadmium); il existe également une suspicion raisonnable d'effet cancérogène chez l'homme. Les poussières ingérées contenant du cadmium causent des dommages aux poumons, au foie et aux reins.
Dans les zones de travail où des composés de cadmium chauffés sont utilisés (stations de soudage et bains de cadmium), veillez à une bonne ventilation ou extraction. Selon l'ordonnance sur l'interdiction des produits chimiques, la teneur en cadmium dans les plastiques ne doit pas dépasser X pour cent en poids (0,01 en mg / kg). Cette limite s'applique dans toute l'Union européenne.
Depuis décembre, 2011 applique une interdiction plus stricte sur le cadmium dans les plastiques, les peintures, les stabilisants et sur certains métaux, conformément au règlement REACH, entrée 23 à l'annexe XVII. Auparavant, le brasage à l'argent contenait généralement 10% à 25% cadmium, des bijoux pour enfants jusqu'à 30%, PVC 0,2%. Avec le 10. En décembre, 2011 a étendu l'interdiction des soudures à base de cadmium dans la soudure et la production et la commercialisation de bijoux plaqués cadmium. En outre, tous les produits contenant du PVC, à l'exception du recyclage du PVC, ont également été inclus. Avec le règlement (UE) 2016 / 217 du 16. En février 2016, du cadmium dans certaines peintures et vernis a été ajouté à l'entrée 23 dans l'annexe XVII du règlement REACH. De plus, la teneur en cadmium de certaines peintures et vernis contenant du zinc ou de produits en contenant est limitée. Il existe des exceptions, par exemple en raison de la densité de puissance élevée des batteries Ni-Cd dans les appareils électriques sans fil.
toxicologie
Le cadmium est un sous-produit inévitable de l'extraction du zinc, du plomb et du cuivre dans l'industrie chimique. Le cadmium peut également être trouvé dans les engrais et les pesticides.
Enregistrement et dangers
L’Organisation mondiale de la santé a décliné à plusieurs reprises, au cours des dernières années, dans son énoncé sur l’apport tolérable de cadmium, 2013 ayant été récemment remplacé par un minimum tolérable (TMI) de 25 μg par kilogramme de poids corporel. L’Autorité européenne de sécurité des aliments a publié le 2009 avec un niveau de 2,5 μg par kilogramme de poids corporel toléré de manière significative.
Le cadmium est absorbé par l'homme principalement par la nourriture. Les aliments riches en cadmium comprennent: le foie, les champignons, les crustacés et autres crustacés, la poudre de cacao et les algues séchées. De plus, les graines de lin contiennent beaucoup de cadmium, raison pour laquelle il est recommandé de ne pas prendre plus de 20 g de graines de lin par jour. En outre, depuis l’introduction d’engrais artificiels, le cadmium s’accumule sur les terres agricoles et donc dans presque tous les aliments. Les ressources en phosphates sont limitées et la plupart des ressources sont contaminées par du cadmium ou des métaux lourds radioactifs. La teneur en cadmium des dépôts de phosphate est très différente. De nombreux pays industrialisés ont déjà introduit une limite pour le cadmium dans les engrais. En Autriche, la concentration de cadmium est limitée à 75 mg / kg P2O5. En outre, la fumée de tabac transporte des quantités relativement importantes de cadmium dans les poumons, d'où elle se propage avec le sang dans le corps.
Les personnes travaillant dans des usines à haute teneur en cadmium sont particulièrement exposées. Mais il y a aussi des dangers des décharges sauvages et des ouvrages en métal. L'inhalation de cadmium peut sérieusement endommager les poumons et même entraîner la mort. Les accidents dans l'industrie - comme dans la province chinoise du Guangdong - et des décennies d'émissions - comme dans le cas de la maladie d'Itai Itai (chez l'homme) et de la maladie de Gressenicher (chez le bétail au pâturage) - mettent clairement en évidence les véritables dangers.
Dommages chez l'homme
Le cadmium peut s'accumuler progressivement dans le corps pour des raisons industrielles ou environnementales et provoquer un empoisonnement chronique difficile à reconnaître.
Le cadmium est absorbé par l'alimentation jusqu'à environ 5% dans l'intestin. Avec les carences en fer et en calcium, le taux d'absorption augmente, ce qui suggère que les trois métaux utilisent la même voie de transport. Le cadmium stimule d'abord dans le foie la synthèse des métallothionéines, avec lesquelles il forme un complexe et est transporté par la circulation sanguine vers les glomérules rénaux où il est filtré et repris des tubules rénaux. Dans les cellules tubulaires, le complexe métallothionéine-cadmium est métabolisé et le cadmium est libéré. Là encore, cd active une synthèse accrue de la métalthione, qui lie encore plus de cadmium. L'accumulation dans les reins cause des dommages à cet organe, entraînant une protéinurie. En raison de cette liaison protéique, le cadmium n'est excrété que très lentement, la demi-vie de l'organisme reste jusqu'à 30. Par conséquent, la teneur en cadmium augmente à partir de la naissance et diminue à nouveau à l'âge de 50-60.
Le cadmium endommage également les os, car il conduit finalement à la mobilisation du calcium. Le Cd entre en compétition dans l'intestin avec le calcium pour les sites de liaison de la protéine de liaison au Ca dans la muqueuse intestinale. De plus, le Cd bloque la synthèse de 1,25-dihydroxycholécalciférol (calcitriol) dans les cellules des tubules rénaux. Le 1,25-Dihydroxycholecalciferol est nécessaire pour activer la synthèse de la protéine de liaison au calcium dans la cellule muqueuse intestinale. En résumé, le cadmium entraîne une réduction de la réabsorption du calcium dans l'intestin et les reins, ainsi qu'une augmentation de l'excrétion dans l'urine avec pour conséquence une libération de calcium par les os et donc une dégradation de celui-ci.
En cas d'intoxication aiguë par le cadmium, l'excrétion biliaire peut être assistée par l'administration de pénicillamine ou de dimercaprol. Un traitement efficace, au-delà du traitement de l'intoxication aiguë au cadmium, n'est pas connu.
symptômes
- Diarrhée, maux d'estomac et vomissements violents
- lésions rénales
- des fractures osseuses
- Dommages au système nerveux central
- Dommages au système immunitaire
- Troubles de la reproduction et peut-être même infertilité
- psychische Störungen
- Dommages possibles à l'ADN et cancérogenèse
- Perte du sens de l'odorat
Liens
→ Catégorie: Composé de cadmium
Oxydes et hydroxydes
- Oxyde de cadmium CdO
- Hydroxyde de cadmium Cd (OH) 2
des halogénures
- Fluorure de cadmium CdF2
- Chlorure de cadmium CdCl2
- Bromure de cadmium CdBr2
- Iodure de cadmium CdI2
chalcogénures
- Sulfure de cadmium CdS
- Séléniure de cadmium CdSe
- Tellurure de cadmium CdTe
Autres composés
- Sulfate de cadmium CdSO4
- Nitrate de cadmium Cd (NO3) 2
- Cyanure de cadmium Cd (CN) 2
- Stéarate de cadmium Cd (C17H35COO) 2
Prix du cadmium -> Prix des métaux stratégiques
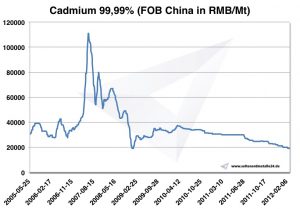
Graphique Cadmium 2005-2012


