Tantale, Ta, numéro atomique 73
Prix, occurrence, extraction et utilisation du tantale
Le tantale [ˈtantalum] est un élément chimique avec le symbole Ta et le numéro atomique 73; dans le tableau périodique, il est dans le cinquième sous-groupe ou groupe vanadium. Il s'agit d'un métal de transition gris graphite brillant, ductile, rare. Le tantale est principalement utilisé pour les condensateurs à haute capacité et en même temps de petite taille. Le métal étant non toxique et inerte aux fluides corporels, il est également utilisé pour les implants, par exemple comme clou osseux.
L'élément a été découvert en 1802 par Anders Gustav Ekeberg dans un minerai de colombite finlandais. Il a séparé un oxyde très stable (l'oxyde de tantale (V)) qui ne s'est dissous dans aucun acide. Il porte le nom de Tantale, une figure de la mythologie grecque. Selon Ekeberg, la raison de ce nom est que l'oxyde très permanent "doit languir et ne peut pas étancher sa soif, comme Tantale dans le monde souterrain".
À peu près au même moment, Charles Hatchett a trouvé quelque chose de très similaire dans un minerai colombien columbium. On pensait que les deux éléments étaient identiques jusqu'en 1844, quand Heinrich Rose a reconnu que deux éléments différents étaient présents dans les minerais de columbite, à savoir le tantale et le columbium. Il a appelé ce dernier niobium.
Après la découverte du nouvel élément, divers chimistes ont tenté de représenter le tantale comme un élément. Le premier à produire du tantale élémentaire en réduisant le fluorure de tantale avec du potassium fut Jöns Jakob Berzelius en 1815. Cependant, comme le tantale représenté par Rose, son métal n'était qu'à 50% de tantale. En 1902, Henri Moissan essaya de produire du tantale dans un four électrique, mais le carbone qu'il contenait rendait son produit très dur et cassant.
Werner von Bolton fut le premier à produire du tantale pur et ductile en 1903. Il y parvint en réduisant les oxydes incandescents dans le vide et en faisant fondre du tantale impur sous vide et en utilisant un arc électrique à flamme.
La première application du nouvel élément était en tant que filament dans les ampoules. La raison du changement de l'osmium précédemment utilisé au tantale était qu'il est plus facile à traiter et a une température utile possible plus élevée pouvant atteindre 2300 ° C. Il a ensuite été remplacé par le tungstène, qui a un point de fusion encore plus élevé et permet ainsi un spectre lumineux plus proche de celui de la lumière du soleil et un rendement lumineux plus élevé.
En 1922, une nouvelle application a été trouvée pour le tantale avec son utilisation dans les redresseurs et un an plus tard dans les tubes radio.
Occurrence
Le tantale est un élément rare sur terre avec une teneur de 2 ppm dans la croûte continentale et de 8 ppm dans la coquille terrestre. La fréquence est comparable à celle de l'arsenic et du germanium. Au sein du groupe, la fréquence diminue d'une puissance de dix. Le tantale ne se produit pas naturellement, mais uniquement sous la forme de ses composés dans divers minéraux. En raison de la similitude des deux éléments, les minerais de tantale contiennent toujours du niobium et vice versa (socialisation). Les minéraux les plus importants sont ceux de la série colombite et tapiolite, dans lesquels divers minéraux de formule générale (Mn, Fe2+) (Nb, Ta)2O6 être résumé. Tantale columbites sont aussi appelés tantalite désigné. Des exemples de minéraux contenant du tantale dans cette série sont la ferrotapiolite (Fe2+, Mn2+) (Ta, Nb)2O6 et manganèse tantalite MnTa2O6. Ces minerais sont souvent appelés coltan. Les minéraux moins courants sont la microlite ou la thoreaulite.
Les principaux pays producteurs de minerais de tantale en 2007 étaient l'Australie avec 850 tonnes et le Brésil avec 250 tonnes. Le coltan se trouve également au Canada et dans divers pays africains comme l'Éthiopie, le Mozambique et le Rwanda. Les gisements de l'est de la République démocratique du Congo, qui ont été âprement disputés lors de la guerre du Congo de 1996 à 2008, sont devenus connus des médias.
Extraction et présentation
Comme le tantale et le niobium sont toujours présents ensemble dans les minerais utilisés pour l'extraction du tantale, ils doivent être séparés pour récupérer les métaux purs. Ceci est compliqué par la grande similitude des deux éléments.
La première méthode de séparation a été développée par Jean Charles Galissard de Marignac en 1866. Il a utilisé la solubilité différente des deux éléments dans l'acide fluorhydrique dilué. Le tantale forme le K légèrement soluble2TaF7, Niobium le K bien soluble3NbOF5 · 2 H2O.
Le procédé utilisé techniquement aujourd'hui est basé sur l'extraction et utilise la solubilité différente de sels complexes de fluor dans l'eau et certains solvants organiques. Le mélange de minerai est d'abord dissous dans de l'acide fluorhydrique concentré ou des mélanges d'acide fluorhydrique et sulfurique. Les fluorures complexes [NbOF5]2- et [TaF7]2-. Après filtration des constituants insolubles, la séparation peut être réalisée par extraction liquide-liquide à l'aide de méthylisobutylcétone. Si de la méthylisobutylcétone est ajoutée à la solution, les complexes de niobium et de tantale passent dans la phase organique, tandis que d'autres éléments, comme le fer ou le manganèse, restent dans la phase aqueuse. Lorsque de l'eau est ajoutée à la phase organique séparée, seul le complexe de niobium s'y dissout, le tantale reste dans la méthylisobutylcétone.
Avec l'aide de fluorure de potassium, le tantale peut être converti en un K peu soluble2[TaF7] être abattu. La réduction en tantale élémentaire se fait principalement par le sodium.
![\ mathrm {K_2 [TaF_7] + 5 \ Na \ longrightarrow Ta + 5 \ NaF + 2 \ KF}](https://upload.wikimedia.org/wikipedia/de/math/4/0/8/4082df7e6f3cde8acd65ddf4230284e5.png)
Réduction au sodium
Une alternative possible à l'extraction est la distillation fractionnée. Les différents points d'ébullition des deux chlorures de pentachlorure de niobium et de pentachlorure de tantale sont utilisés à cet effet. Ceux-ci peuvent être obtenus à des températures élevées à partir des minerais avec du chlore et du coke. Après la séparation, le chlorure de tantale est également réduit en métal avec du sodium.
En plus des minerais de columbite-tantalite, les scories provenant de la fusion de l'étain sont une source importante pour l'extraction du tantale (contient quelques pour cent de tantale).
Propriétés physiques

Structure cristalline de tantale,a = 330,3 pm
Le tantale est un métal lourd à point de fusion élevé, d'un gris violet distinctif, dur comme de l'acier (dureté Vickers: 60–120 HV), similaire au niobium dans la plupart de ses propriétés. Il cristallise dans une structure cristalline cubique centrée sur le corps. Avec un point de fusion d'environ 3000 ° C, le tantale a le point de fusion le plus élevé de tous les éléments après le tungstène, le carbone et le rhénium. Si seulement une petite quantité de carbone ou d'hydrogène est stockée dans le métal, le point de fusion augmente considérablement. Avec un point de fusion de 3880 ° C, le carbure de tantale possède l'un des points de fusion les plus élevés de toutes les substances.
Le tantale devient un supraconducteur en dessous d'une température de transition de 4,3 Kelvin.
Alors que le tantale pur est ductile et peut être considérablement étiré (résistance à la traction: 240 MPa), même de petites quantités de carbone ou d'hydrogène qui y sont ajoutées modifient considérablement la résistance mécanique. Le matériau devient fragile et difficile à traiter. Cet effet est utilisé pour produire de la poudre de tantale. Dans la technologie, il est chargé d'hydrogène et donc fragilisé, puis broyé en conséquence et cuit ou libéré à nouveau de l'hydrogène à une température plus élevée.
Propriétés chimiques
Le tantale est un métal de base et réagit à des températures élevées avec la plupart des non-métaux, tels que l'oxygène, les halogènes ou le carbone. A température ambiante, cependant, le métal est protégé par une fine couche d'oxyde de tantale (V) et donc passivé. Une réaction n'a lieu qu'à partir d'une température d'environ 300 ° C.
Dans la plupart des acides, le tantale n'est pas soluble en raison de la passivation, même l'eau régale ne peut pas dissoudre le métal. Le tantale n'est attaqué que par l'acide fluorhydrique, l'oléum (un mélange d'acide sulfurique et de trioxyde de soufre) et de sels fondus.
isotope
Il existe au total 30 isotopes et 26 isomères de cœur de 155Ta place 185Ta connu. Le tantale naturel se compose presque exclusivement (99,988%) de l'isotope 181Ta. 0,012% de l'isomère de noyau est également présent 180mTa avant. Bien que cela puisse théoriquement être radioactif, aucune désintégration n'a été observée jusqu'à présent. La demi-vie doit donc dépasser 1 · 1015 Années
Utiliser
La majeure partie du tantale (volume de production annuel mondial de 1.400 2007 t) est utilisée pour de très petits condensateurs à haute capacité. En 60, XNUMX% du tantale était utilisé dans la fabrication de condensateurs. Ces condensateurs électrolytiques au tantale sont utilisés partout dans la microélectronique moderne, par exemple pour les téléphones portables et dans la construction automobile. L'effet est basé sur la couche d'oxyde de tantale sur la surface de la feuille de tantale enroulée, qui est toujours stable et isolante de manière fiable même dans une version très mince. Plus la couche entre les électrodes est fine, plus la capacité est élevée avec la même surface de feuille; De plus, l'oxyde de tantale a une permittivité extrêmement élevée, ce qui augmente également la capacité.
Étant donné que le tantale n'est pas toxique et ne réagit pas avec les tissus ou les liquides corporels, le tantale élémentaire est utilisé pour les implants et instruments médicaux. Par exemple, les clous à os, les prothèses, les pinces et les vis à mâchoires sont en tantale. De plus, il s'agit d'un produit de contraste pour rayons X rarement utilisé en raison de ses coûts élevés.
Dans l'industrie chimique, le tantale est utilisé en raison de sa durabilité. Il sert de matériau de revêtement pour les cuves de réaction et est utilisé pour les échangeurs de chaleur et les pompes. Dans la plupart des cas, le tantale pur n'est pas utilisé à ces fins, mais des alliages contenant 2,5 à 10% de tungstène. Ceux-ci sont plus stables et résistants que le tantale pur. En même temps, la ductilité souhaitée est conservée. D'autres utilisations sont les équipements de laboratoire, les filières et les cathodes des tubes électroniques. Ici, le tantale profite du fait qu'il est capable d'absorber jusqu'à 800 parties en volume de gaz à 740 ° C (effet getter), ce qui assure un vide poussé dans les tubes.
Les superalliages, qui sont utilisés dans la construction de turbines et de moteurs d'avion, contiennent jusqu'à 9% de tantale. L'ajout de 3 à 4% de tantale à un superalliage de nickel augmente la résistance du matériau à des températures élevées.
Sicherheitshinweise
Travailler avec le tantale et ses composés ne pose normalement aucun problème dans des conditions de laboratoire. Les composés élémentaires de tantale et de tantale ne sont pas toxiques. Cependant, il existe de vagues indications que certains composés de tantale sont cancérigènes. La poudre et la poussière de tantale - comme les autres métaux finement divisés - présentent un risque élevé d'incendie et d'explosion.
Liens
Oxyde de tantale (V) Ta2O5 est une poudre blanche utilisée dans la fabrication de verres hautement réfractifs et de matériaux cristallins spéciaux.
Le carbure de tantale TaC, avec sa température de fusion de 3880 ° C et une dureté proche de celle d'un diamant, sert de couche protectrice sur les alliages haute température dans les moteurs et les outils de coupe.
| Général | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom, symbole, numéro atomique | Tantale, Ta, 73 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La Gamme | Les métaux de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 5, 6, j | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | gris | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| numéro CAS | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fraction de masse de la coquille de terre | 8 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| nucléaire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| masse atomique | 180,9479 unités | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calculé) | 145 (200) après-midi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalent | 138 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| configuration électronique | [Xe] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionisation | 761 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionisation | 1500 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| physiquement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| L'état physique | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| la structure cristalline | cubique centré sur le corps | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| densité | 16,65 g / cm3 (20 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| dureté Mohs | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnétisme | paramagnétique ( = 1,8 10-4) = 1,8 10-4) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| point de fusion | 3290 K (3017 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| point d'ébullition | 5731 K (5458 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 10,85 · 10-6 m3/ mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 735 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| la chaleur de fusion | 36 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| vitesse du son | 3400 m / s à 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique spécifique | 140 J / (kg · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 7,61 · 106 A / (V · m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| conductivité thermique | 57 W / (m K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chimique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| états d'oxydation | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| potentiel normal | −0,81 V (½ Ta2O5 + 5 H.+ + 5 e- → Ta + 2½ H2O) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| électronégativité | 1,5 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| propriétés RMN | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Prix du tantale
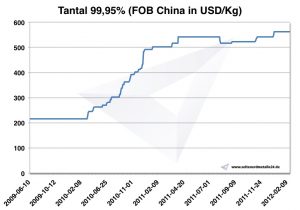
Graphique Tantale 2009-2012
Prix actuels du tantale


