Tellure, Te, numéro atomique 52
Prix, occurrence, extraction et utilisation du tellure
Tellurium [tʰɛluːɐ̯] (tellus latin "terre") est un élément chimique rare dont le symbole est Te et le numéro atomique 52. Dans le tableau périodique, il se situe dans le sixième groupe principal, ou 16. Groupe IUPAC et 5. Période et est l'un des Chalkogènes. Sa fréquence est similaire à celle de l'or, avec lequel il entre également dans divers composés présents dans la nature sous forme de minéraux. Le tellure cristallin est un semi-métal métallique brillant, blanc argenté, qui ressemble à l'étain et à l'antimoine. Il réagit de manière fragile aux contraintes mécaniques et peut donc être facilement pulvérisé. Dans les composés chimiques avec des non-métaux, son comportement est proche de celui du soufre et du sélénium, de ses alliages et de ses composés intermétalliques. Cependant, il présente des propriétés (semi) métalliques très prononcées.
Histoire
Tellurium était 1782 du chimiste et minéralogiste autrichien Franz Joseph Mueller von Reichenstein (1740-1825) dans le cadre de recherches sur des minerais d’or de la mine Mariahilf sur le mont Faczebaja à Zlatna (allemand Klein Schlatten, Zalatna) près de Sibiu (allemand Hermannstadt , Transylvanie, Roumanie), qui ont produit moins d’or que prévu. Il avait découvert les minerais du traité scientifique d'Ignaz von Born (1742-1791) sur le Spiesglaskönig en Transylvanie. Spiesglaskönig fait référence à l'antimoine solide, Spies glass est un ancien nom du minéral Antimonit (Stibnit, Grauss casting Sb2S3). Von Born a conservé le métal solide dans le minerai d'or pour l'antimoine et a attribué le faible rendement à une combinaison d'or et d'antimoine. Mueller von Reichenstein a contredit ce point de vue et l'a retenu d'abord pour "bismuth sulfuré". Après des recherches plus approfondies, dont il a publié les résultats entre 1783 et 1785 dans un essai en quatre parties, il exclut également le bismuth, car le métal, contrairement à l’antimoine et au bismuth, ne réagissait pratiquement pas avec l’acide sulfurique. Il a donné à la phase métallique le nom de metallum problematicum (également aurum problematicum ou aurum paradoxum). Selon les connaissances actuelles, il existe à côté du tellure solide des minéraux Nagyágit (feuilles minérales, AuPb (Pb, Sb, Bi) Te2-3S6) et Sylvanite (polices, (Au, Ag) Te2). Mueller von Reichenstein a suggéré que le metallum problematicum "... peut-être un nouveau semi-métal non encore reconnu", souhaitait ses découvertes, mais uniquement par le minéralogiste et chimiste suédois Torben Olof Bergman (1735-1784). L'année 1783, il a envoyé des échantillons du minerai à Bergman pour examen, mais il n'a pas reçu de réponses définitives. Bergman est mort 1784 et les investigations sur metallum problematicum ont été interrompues pour le moment.
Ce n’est que douze ans plus tard, l’année 1797, que Martin Heinrich Klaproth (1743-1817) a reçu des échantillons des minerais de Müller von Reichenstein à Berlin. Klaproth a confirmé les conclusions des enquêtes de Müller von Reichenstein et a trouvé suffisamment de preuves pour la découverte d'un nouvel élément. En janvier, 1798 Klaproth a salué les mérites de Müller von Reichenstein lors d'une conférence et lui a attribué la découverte du nouvel élément. Comme Mueller von Reichenstein n’avait pas donné de nom à l’élément, Klaproth décida de lui donner le nom de Tellurium (latin tellus: "terre"):
Pour combler cette lacune dans la minéralogie chimique, je présente ici mes expériences et expériences avec ces précieux minerais, dont le principal résultat est la découverte et la validation d'un nouveau métal particulier, auquel j'ajoute le nom de Tellurium emprunté à la vieille Terre nourricière. "
Les pièces à main originales de l'échantillon de matériau de la localité type Zlatna, que Klaproth avait à sa disposition, se trouvent aujourd'hui au Musée d'histoire naturelle de Berlin.
Indépendant de Müller von Reichenstein et de Klaproth, 1789 découvre le chimiste et botaniste hongrois Paul Kitaibel (1757-1817), le tellurium, lors d'enquêtes sur le minerai d'or du village minier Nagybörzsöny (Deutsch-Pilsen) en Hongrie. Klaproth a toutefois mentionné dans son exposé que seul Müller von Reichenstein, bien qu’il soit depuis 1796 par un manuscrit, Kitaibels, également au courant de ses investigations. Dans une lettre à Kitaibel, Klaproth a déclaré qu'il avait perdu le contenu du manuscrit et qu'il n'avait vu aucun lien avec son travail dans les enquêtes sur le minerai Müller von Reichenstein. Enfin, Klaproth a finalement convaincu Kitaibel que la découverte du tellure devrait être attribuée à Mueller von Reichenstein seul, qui avait fait les mêmes observations sur le nouvel élément plusieurs années auparavant.
Le symbole de l'élément "Te" a été proposé à 1814 par Jöns Jakob Berzelius (1779-1848) et est toujours utilisé aujourd'hui. La première structure du tellure cristallin avec diffraction des rayons X a été élucidée par 1924.
Occurrence
Le tellure est un élément rare. sa contribution à la croûte terrestre est d'environ 0,01 ppm (g / t). Avec l’or, subordonné à l’argent, au cuivre, au plomb et au bismuth, ainsi qu’au platine, il se produit rarement avec dignité, c’est-à-dire sous forme élémentaire.
Le tellure solide appartient au groupe des éléments, en particulier des semi-métaux et des non-métaux, et fait partie de la classification des minéraux selon Strunz sous le numéro I / B.03-40 (édition 8) ou 1.CC.10 (9. Edition) et conduit à Dana sous le numéro 1.3.4.2.
Des traces à des quantités plus importantes de sélénium peuvent être contenues dans le tellure solide (sélénium). Bien que le tellure soit un élément rare, un nombre relativement important de minéraux est connu car le tellure forme ses propres minéraux car il est rarement incorporé dans des sulfures ou des séléniures ou des sulfates ou des sélénates; il est trop grand pour ces réseaux cristallins d'homologues plus légers. Inversement, les deux homologues plus légers représentent plus fréquemment le tellure au niveau de ses sites de réseau dans les structures cristallines de minéraux contenant du tellure.
Le tellure présente la plus grande affinité pour l'or de tous les éléments et se trouve donc souvent dans la nature sous la forme de tellurures d'or, de minéraux avec des anions tellurure (Te2) ou ditellurure (Te22-). Outre l'or et d'autres métaux précieux, le plomb et le bismuth forment des tellurures plus naturels, accompagnant souvent (les paragénésiens) les métaux nobles et les minerais d'or.
Plus rares sont les minéraux contenant des cations Te4 + dans la structure cristalline, l’oxyde de tellure le plus important, le dioxyde de tellure, TeO2, se présentant sous deux modifications: la tellurite orthorhombique et la paratellurite tétragonale. Les autres cations du tellure (IV) sont les oxotellurates (IV) (tellurites) contenant un complexe [TeO3] 2 ou [TeO4] 4. Les minéraux contenant des cations Te6 + sous forme d'anions complexes octaédriques [TeO6] 6 sont extrêmement rares, les minéraux 21 contenant principalement du cuivre et du plomb. En plus des minéraux mentionnés, des minéraux de tellure à valence mixte existent également dans la nature, y compris l'oxo-tellurate de calcium (IV, VI). Les cations sont des minéraux secondaires résultant de l'altération du tellure et du tellurure.
Les minéraux contenant du tellure n’ont aucune importance pour la production technique de tellure, car ils sont rares et il n’existe pratiquement aucun gisement d’exploitation minière. En plus de la localité type Zlatna (Transylvanie, Roumanie), les minéraux bien connus riches en tellure incluent Moctezuma (Mexique), Cripple Creek (Colorado), Kalgoorlie (Australie) et Calaveras (Californie). Jusqu'à présent (à partir de 2012), on connaît des minéraux contenant du tellure 154, mais cinq d'entre eux (dilithium, imgreit, kurilite, sztrokayite, protojoseite) n'ont pas encore été reconnus ou discrédités par l'Association minéralogique internationale (IMA).
Extraction et présentation
Le tellure et le sélénium sont obtenus industriellement exclusivement à partir de sous-produits de la production à grande échelle de cuivre et de nickel électrolytiques. Les suspensions anodiques résultantes contiennent des tellurures et des séléniures de métaux précieux insolubles dans l’eau de formule générale M2Ch (M = Cu, Ag, Au, Ch = Se, Te) qui, à des températures supérieures à 500 ° C sous oxygène atmosphérique (O2) avec de la soude (carbonate de sodium Na2CO3) ) ont réagi. Les cations de métaux nobles (M +) sont ainsi réduits en métaux élémentaires (M), ce qui oxyde les anions tellurures en oxo-tellurates (IV) (TeO32-):
Alternativement, cette réaction peut également être réalisée avec de l'acide nitrique (nitrate de sodium NaNO3) en l'absence d'air et la formation d'oxydes d'azote (NO et NO2):
Le tellurate de sodium (Na) Na2TeO3 résultant est ensuite dissous dans de l’eau, où il réagit de manière fondamentale et forme des ions hydrogentellurate (IV) HTeO3-. La séparation des tellurates (IV) des sélénates également formés (IV) dans la solution basique par neutralisation avec addition d'acide sulfurique (H2SO4), qui précipite dans de l'eau du dioxyde de tellure presque insoluble, TeO2:
Le dioxyde de tellure peut être réduit en tellures élémentaires dans des lessives par électrolyse ou par des moyens chimiques par dissolution dans des acides minéraux concentrés et introduction de dioxyde de soufre SO2, le soufre étant formé à partir des molécules SO2 (ou des ions sulfite SOxnumx formés dans la solution). ) et les ions sulfate (SO32-) sont formés:
Le procédé de fusion par zone est utilisé pour obtenir du tellure de haute pureté (> 99,9%).
La production annuelle mondiale de tellure a augmenté de 298 en tonnes 2013 de 53% à 457 en année 2017, avec une moyenne de 382,8 en tonnes par an (t / a). Les principaux producteurs sont la Chine (∅ 220,0 t / a), les États-Unis (50,0 t / a), la Russie (35,6 t / a), la Suède (32,4 t / a), le Japon (∅ 31,8 t / a) et Canada (∅ 13,0 t / a). Un aperçu des quantités de production de chaque pays est présenté dans le tableau. D'autres pays industrialisés, tels que l'Allemagne et la Belgique, produiront probablement du tellure, mais aucun chiffre n'est disponible. [17] Le US Geological Survey (USGS) estime les réserves mondiales de tellure en 2019 à environ 31.000 tonnes.
| Transport routier | 2013 | 2014 | 2015 | 2016 | 2017 | ∅ |
|---|---|---|---|---|---|---|
| Chine | 150 | 180 | 210 | 279 | 281 | 220,0 |
| États-Unis | 50 | 50 | 50 | 50 | 50 | 50,0 |
| Russie | 31 | 33 | 34 | 40 | 40 | 35,6 |
| Suède | 24 | 31 | 33 | 39 | 35 | 32,4 |
| Japon | 31 | 32 | 34 | 28 | 34 | 31,8 |
| Canada | 12 | 9 | 9 | 18 | 17 | 13,0 |
| bourdonnement | 298 | 335 | 370 | 454 | 457 | 382,8 |
 |
||||||
modifications
Tellure cristallin
Dans les conditions standard, seule une modification cristalline (Te-I ou α-Te) du tellure est connue, elle est appelée tellure cristallin ou métallique. Il est isotypique en α-sélénium, c'est-à-dire qu'il présente la même structure cristalline. Dans le système cristallin trigonal du groupe spatial P3121 (N ° 152), le tellure cristallise avec les paramètres de réseau a = 446 pm et c = 592 pm et trois unités de formule dans la cellule unitaire (la plus petite unité de la structure cristalline).
Le groupe spatial P3121 (n ° 152), décrit selon la symbolique Hermann Mauguin, explique le centrage de la maille élémentaire et les éléments de symétrie existants. P signifie que le réseau de Bravais est primitif. Les informations de centrage sont suivies des éléments de symétrie existants du groupe spatial: 31 décrit un triple axe de vis (multiplication d'une particule par rotation de 120 ° et déplacement (translation) de 1/3 dans le sens de l'axe de rotation) parallèle à l'axe c cristallographique ([001] ), 2 décrit un double axe de rotation (multiplication par rotation de 180 °) parallèle aux trois axes a cristallographiques (<100>), 1 l'élément de symétrie de l'axe unique de symétrie ou d'identité (multiplication par rotation de 360 °, donc la particule est formée sur lui-même) dans la direction perpendiculaire aux axes a et à l'axe c (<120>).
La structure cristalline ne contient qu'un seul atome de tellure pouvant être distingué par cristallographie, avec les coordonnées de position x = 0,2636, y = 0 et z = 1 / 3. Tous les autres atomes de la structure cristalline peuvent être attribués à cet atome par les éléments de symétrie existants du groupe spatial. Puisque l'atome de tellure coïncide dans sa position avec le double axe de symétrie du groupe d'espaces (P3121 (No. 152)), il est multiplié exclusivement par le triple axe de la vis (31). Il en résulte des chaînes hélicoïdales d'atomes de tellure liés par covalence parallèles à l'axe c. Les atomes de tellure sont dans la chaîne 284 pm séparés, l'angle de liaison est 103,1 °. Les maillons de la chaîne sont surlignés en rouge dans les illustrations; une chaîne est représentée en bleu pour plus de clarté. L'atome bleu foncé est sur z = 1 / 3, le bleu du milieu sur z = 2 / 3 et le bleu clair sur z = 1 ou z. = 0 est situé. Chaque troisième atome de la chaîne est donc congruent. Chaque chaîne est entourée de six autres chaînes. Des liaisons de Van der Waals existent entre les chaînes avec des distances Te-Te de 349 pm (représentées par des lignes pointillées vertes), résultant de la chute en dessous du rayon de van der Waals (2 · 206 pm = 412 pm) des atomes de tellure , Pour un atome de tellure unique, il en résulte un nombre de coordination de 6, plus précisément 2 + 4, car les atomes 2 proviennent de la même chaîne et ont donc une distance inférieure à celle des autres 4 des chaînes voisines. En tant que polyèdre de coordination, il en résulte un octaèdre distordu (surligné en jaune).
Le tellure peut également se cristalliser dans le groupe d'espace P3221 (# 154) au lieu de P3121 (# 152). L'axe des vis 32 duplique également un atome en le faisant pivoter autour de 120 °, mais le décale ensuite de 2 / 3 au lieu de 1 / 3 dans la direction de l'axe de rotation. Cela crée également des chaînes hélicoïdales qui s'enroulent dans le sens des aiguilles d'une montre plutôt que dans le sens contraire des aiguilles d'une montre (dans l'axe de la vis 31) le long de l'axe c. La structure cristalline du groupe d'espace P3221 (No. 154) ("gauche") est donc l'image miroir de la structure du groupe d'espace P3121 (No. 152) ("forme juridique"). L’apparition de formes cristallines en miroir est appelée énantiomorphisme en cristallographie.
Le système cristallin de tellure est souvent appelé hexagonal. Le système cristallin hexagonal et trigonal est basé sur la même unité de cellule, mais une symétrie hexagonale nécessiterait la présence d'un axe de symétrie six fois (6, multiplication d'une particule par rotation autour de 60 °). Cependant, la structure cristalline du tellure ne contient que le triple axe de la vis (31) et appartient donc sans aucun doute au système cristallin trigonal symétrique inférieur.
Dans des expériences à haute pression avec du tellure cristallin (Te-I ou α-tellure), d'autres modifications ont été découvertes. Les plages de pression spécifiées pour la stabilité des modifications varient en partie dans la littérature:
- Le Te-II cristallise dans le système cristallin monoclinique dans une plage de pressions allant de 4 à 6,6 GPa. C2 / m (n ° 12) et P21 (n ° 4) sont mentionnés dans la littérature en tant que groupes d'espace possibles.
- Le Te-III cristallise dans le système cristallin orthorhombique et reste stable dans la plage de pression supérieure à 6,6 GPa. Pour une modification orthorhombique, un calcul théorique existe dans le groupe d'espace Imma (n ° 74).
- Te-IV cristallise dans le système cristallin trigonal du groupe spatial R3m (N ° 166) et correspond à la structure du β-polonium. Il est stable dans la plage de pression de 10,6 à 27 GPa. Les distances des atomes de tellure dans les chaînes et par rapport aux chaînes adjacentes dans cette modification sont les mêmes et correspondent chacune à 300 pm, ce qui donne une symétrie plus élevée par rapport à α-Te.
- Te-V est stable au-dessus de 27 GPa. Pour cette modification, on suppose un réseau centré sur le corps cubique (groupe d'espace Im3m (# 229)).
Tellure amorphe
La modification amorphe instable est une poudre brune et peut être préparée à partir d'acide tellurique (H2TeO3) par réaction avec de l'acide sulfureux (H2SO3) ou des ions sulfites (SO32-). Les ions sulfite sont ainsi oxydés en ions sulfate (SO42-), tandis que les cations Te4 + sont réduits en tellure élémentaire:
Le tellure amorphe se convertit lentement en modification cristalline dans des conditions normales.
Propriétés physiques
Le tellure cristallin est un semi-conducteur direct intrinsèque avec une bande interdite de 0,334 eV. Comme pour tous les semi-conducteurs, la conductivité électrique peut être augmentée en augmentant la température ou l'exposition, mais cela n'entraîne qu'une légère augmentation du tellure. La conductivité électrique et la conductivité thermique se comportent de manière directionnelle en fonction du tellure, c’est-à-dire anisotrope. Le tellure cristallin est un matériau mou (Mohs 2,25) et fragile, facile à transformer en poudre. En augmentant la pression, le tellure se transforme en modifications cristallines supplémentaires. Au-dessus de 450 ° C, le tellure passe dans une masse fondue rouge et, à des températures supérieures à 990 ° C, il est présent sous forme de gaz diamagnétique jaune des molécules de Te2. À des températures supérieures à 2000 ° C, les molécules de Te2 se décomposent en atomes simples.
Propriétés chimiques
Le tellure cristallin est insoluble dans l’eau et peu soluble dans les acides minéraux, l’acide chlorhydrique et l’acide sulfurique et dans les alcalis. En revanche, il est très soluble dans l’acide nitrique car c’est un agent oxydant très puissant qui oxyde le tellure élémentaire en tellurates à l’état d’oxydation stable + IV. Le tellure fondu attaque le cuivre, le fer et l'acier inoxydable.
Dans les composés contenant des non-métaux, le tellure se comporte comme le sélénium, membre du groupe plus léger. TeO2, le dioxyde de tellure, brûle dans une flamme bleue rayée de vert dans l'air.
Le tellure réagit spontanément avec les halogènes pour former des halogénures de tellure. De manière remarquable, contrairement au sélénium et au soufre, homologues plus légers, le tellure forme également des iodures thermodynamiquement stables, y compris l'iodure de tellure TeI à l'état d'oxydation + I. Avec les métaux de base tels que le zinc, il réagit violemment aux tellurures correspondants.
isotope
Le tellure est connu pour ses isotopes numérotés en masse entre 105 et 142. Le tellure naturel est un élément mixte composé de huit isotopes, dont cinq (122Te, 123Te, 124Te, 125Te, 126Te) sont stables. L'isotope 123Te devrait théoriquement se désintégrer en 123Sb sous capture d'électrons. Cependant, cette décroissance n'a pas encore été observée; la limite inférieure de sa demi-vie est 9,2 · 1016 années (92 quadrillions d’années). L'isotope 120Te passe directement dans 120Sn via la capture par double électron. Les isotopes 128Te et 130Te sont convertis en 128Xe et 130Xe, respectivement, par émission de rayonnement bêta (double désintégration bêta).
Environ un tiers de l'isotope 130Te avec une demi-vie de 7,9 · 1020, suivi de l'isotope 128Te, est le principal contributeur au tellure naturel. La masse atomique moyenne des isotopes naturels du tellure est donc 127,60, qui est supérieure à celle de l'élément pur, l'iode, 126,90 figurant dans le tableau périodique. 128Te est considéré comme l'isotope ayant la décroissance la plus lente de tous les isotopes non stables de tous les éléments. La décroissance extrêmement lente avec une demi-vie de 7,2 · 1024 années (7 quadrillions d’années, c’est-à-dire en kilogrammes 1 un atome désintègre tous les mois 18) ne peut être déterminée que par la détection du produit de désintégration (128Xe) dans de très vieux échantillons de tellure naturel.
Parmi les autres isotopes, l’isomère principal 121mTe a la demi-vie la plus longue avec les jours 154. De même, pour les isotopes 127Te et 129Te, les demi-vies des isomères sont supérieures à celles de l'état fondamental. Le traceur le plus couramment utilisé est l'isotope 127Te, suivi de 121Te. Les isotopes 127Te et 129Te apparaissent également sous forme de produits de fission dans la fission nucléaire dans les réacteurs nucléaires.
Utiliser
Le tellure est un élément techniquement moins important car il est coûteux à fabriquer et d'autres éléments ou composés sont souvent équivalents en utilisation. En 2016, un comportement thermoélectrique au tellure élémentaire, polycristallin et dopé avec un chiffre de mérite élevé dans la plage entre la température ambiante et 400 ° C a été démontré. Le tellure élémentaire est utilisé dans l'industrie métallurgique comme additif (<1%) pour l'acier, la fonte, le cuivre et les alliages de plomb et dans l'acier inoxydable. Il favorise la résistance à la corrosion et améliore les propriétés mécaniques et l'usinabilité. Le tellure pur n'a jusqu'à présent été utilisé que rarement comme semi-conducteur; le tellure est principalement utilisé dans les semi-conducteurs composés II-VI. Le tellurure de cadmium CdTe est z. B. utilisé dans les photodiodes et les cellules solaires à couches minces pour générer de l'électricité à partir de la lumière.
Le tellurure de bismuth Bi2Te3 est utilisé dans les thermocouples pour générer de l'électricité dans des générateurs thermoélectriques (par exemple, des batteries à radionucléides) ou dans des éléments à effet Peltier pour le refroidissement.
Des combinaisons de GeTe germanium et de tellurure d'antimoine Sb2Te3 sont utilisées dans des matériaux à changement de phase faisant partie de disques de stockage optiques (par exemple, des CD-RW) ou dans de nouveaux matériaux de stockage tels que les mémoires à accès aléatoire à changement de phase.
En raison de leurs indices de réfraction élevés, les verres en dioxyde de tellure TeO2 sont utilisés à la place du verre de silice SiO2 dans les guides d’ondes optiques.
En microbiologie, la gélose mélangée K2TeO3 au tellurate de potassium incolore (IV) est utilisée comme milieu nutritif sélectif pour la détection des staphylocoques et de Corynebacterium diphtheriae. Les colonies bactériennes apparaissent comme de petites sphères noires, car elles réduisent les cations Te4 + en tellure élémentaire et les stockent dans leurs cellules.
Le tellure (ou tellurate de potassium) a d'abord été utilisé en médecine par 1890 pour le traitement de la transpiration nocturne chez les patients atteints de tuberculose.
De plus, de petites quantités de tellure sont utilisées pour la vulcanisation du caoutchouc, dans les détonateurs et pour la teinture du verre et des céramiques. Les sels de tellure sont en partie utilisés pour produire une couleur verte d'herbe dans les feux d'artifice.
Consignes de sécurité et toxicité
Sous sa forme soluble, le tellure est un élément toxique pour l'organisme humain et a donc été classé comme toxique dans le passé. Cependant, comme le tellure élémentaire est très peu soluble dans l'eau et les propres acides du corps, il a été déclassé en nocif. Des études menées par l'Organisation néerlandaise pour la recherche scientifique appliquée (TNO) ont montré que la valeur DL50 (orale) chez le rat est> 5000 mg / kg. La valeur de 83 mg / kg donnée dans de nombreuses fiches de données de sécurité du livre Paramètres toxicométriques des produits chimiques toxiques industriels sous exposition unique par NF Ismerow, qui date de 1982, [26] ne s'applique qu'aux composés de tellure facilement solubles. Malgré cela, divers fabricants continuent d'utiliser l'ancienne valeur DL50 pour le tellure élémentaire (poudre) et la classification toxique en relation avec la phrase H 301 («toxique en cas d'ingestion»).
Le tellure n'est pas aussi toxique que le sélénium. Ceci est analogue aux éléments voisins du 5. Groupe principal, où l'antimoine est également moins toxique que l'arsenic. Si le tellure, en particulier sous forme de composés de tellure facilement solubles tels que les tellurates de métaux alcalins (par exemple, Na2TeO3) par ingestion (par voie orale) dans le corps, se forme par réduction du diméthyltellurure toxique (Me2Te: H3C-Te-CH3), qui provoque des lésions sanguines du foie Peut causer le coeur et les reins. Puisque les composés de tellure facilement solubles libèrent beaucoup plus de tellure, ils sont également classés comme plus dangereux. L'empoisonnement au tellure se manifeste par une odeur intense d'ail d'air respirable, causée par le diméthyltelluride, d'abord par Christian Gottlob Gmelin, 1824 (pour ses premières études sur l'effet du tellure sur les êtres vivants). Cela prendra plusieurs semaines pour se développer et se développer même à des niveaux très bas, qui ne causent pas d'intoxication grave. Contrairement à l’ail véritable, cette odeur d’ail ne peut pas être enlevée en se brossant les dents. Il s'installe également dans une pièce et ne s'éloigne qu'après plusieurs heures. Il est également lentement excrété à travers la peau.
Les poussières de Tellurst peuvent s'enflammer spontanément dans l'air et, lorsqu'elles sont finement réparties à une concentration correspondante, peuvent également réagir de manière explosive en formant dans chaque cas du dioxyde de tellure, TeO2. Comme les autres poussières métalliques, la poudre de tellure peut également réagir de manière explosive avec des composés interhalogénés tels que le pentafluorure de brome BrF5. Une concentration maximale sur le lieu de travail (MAK) pour le tellure n'a pas été établie.
preuve
Le tellure élémentaire peut être détecté dans l'acide sulfurique concentré chaud (H2SO4) par oxydation du tellure pour former le cation rouge Te42 + (dication tétratellurique). Une partie de l'acide sulfurique est réduite dans la réaction en acide sulfurique (H2SO3), qui se décompose en raison des températures élevées de l'eau (H2O) et de son anhydride anhydride sulfureux (SO2), qui s'échappe sous forme de gaz:
La couleur du cation Te42 + à plan carré est due à six électrons π délocalisés qui absorbent une partie de la lumière visible. Les longueurs d'ondes de lumière non absorbées restantes donnent la couleur complémentaire rouge.
Tellurate et tellurite peuvent être spécifiés au moyen d'une polarographie, c'est-à-dire sélectivement déterminés côte à côte. Alors que le niveau de tellurate est -1,66 V, celui de tellurite apparaît à -1,22 V (vs SCE, soude caustique 0,1 M). Les deux espèces de tellure sont réduites en une étape en tellurure. Les traces de 0,03% tellurate ou 0,003% tellurite sont détectables de cette manière. Les méthodes de spectroscopie atomique sont beaucoup plus puissantes. Alors que le SAA de flamme atteint une limite de détection de 20 μg / l, cette valeur est beaucoup plus basse pour le SAA à tube en graphite (0,2 μg / l) et la technique à l’hydride (0,02 μg / l).
tellure
Dans les composés, le tellure apparaît le plus souvent dans les états d'oxydation -II (tellurures) et + IV (tétrahalogénures, dioxyde de tellure et tellurates (IV), tellurites obsolètes). Plus rares sont les états d'oxydation + VI (tellurates (VI)) et + II (dihalogénures) ainsi que -I (ditellurides) et + I (monohalogénures, connus uniquement sous le nom de TeI).
composés à hydrogène
L'hydrogène tellurique H2Te est un gaz incolore et hautement toxique produit par la réaction de tellurures (MxTey) avec des acides forts tels que l'acide chlorhydrique HCl. À partir des éléments (hydrogène et tellure), le composé ne peut être représenté comme composé fortement endothermique qu'à des températures supérieures à 650 ° C. Dissous dans l'eau (acide tellurique), il réagit acide, l'acidité correspond approximativement à l'acide phosphorique. Dans l'air, la solution aqueuse se décompose immédiatement en eau et en tellure élémentaire.
composés oxygénés
Dioxyde de tellure (oxyde de tellure (IV)) TeO2 est un solide cristallin incolore et l’oxyde de tellure le plus important. Il résulte de la combustion de tellure élémentaire avec de l'air. C'est l'anhydride de l'acide tellurique faiblement amphotère et instable H2TeO3. Le dioxyde de tellure existe dans une modification orthorhombique (tellurite) et tétragonale (paratellurite), également présente dans la nature sous forme de minéraux.
Trioxyde de tellure (oxyde de tellure (VI)) TeO3 est un solide jaune cristallisant trigonal / rhomboédrique et l’anhydride de l’acide orthotellurique H6TeO6. Il résulte du drainage de l'acide orthotellurique par une forte augmentation de la température. La couleur jaune est due au transfert d'électrons de l'oxygène au tellure ("transfert de charge").
Le monoxyde de tellure (oxyde de tellure (II)) TeO en est un autre, mais dans des conditions normales, l’oxyde instable de tellure. Il est décrit comme un solide noir amorphe et réagit dans l'air humide avec l'oxygène pour former le dioxyde de tellure plus stable, TeO2.
Le pentoxyde dicellulaire (tellure de tellure (IV)) est un oxyde de tellure mélangé avec les cations Te4 + et Te6 +. C'est en plus du trioxyde de tellure un autre produit de la décomposition thermique de l'acide orthotellurique et cristallisé dans le système cristallin monoclinique.
Les tellurates sont les sels de l'acide orthotellurique H6TeO6 et de l'acide métatellurique H2TeO4 avec les anions [TeO6] 6- ou [TeO4] 2-. Les sels de l'acide tellurique H2TeO3 avec l'anion [TeO3] 2- sont appelés tellurates (IV) (tellurites obsolètes).
des composés halogènes
Les tétrahalogénures TeX4 avec du tellure à l'état d'oxydation + IV sont les halogénures de tellure les plus courants. Ceux-ci sont connus avec tous les halogènes (fluor, chlore, brome et iode). Tous les composés sont des solides cristallins.
Les dihalogénures TeX2 au tellure à l'état d'oxydation + II ne sont connus qu'avec le chlore, le brome et l'iode, ils n'existent qu'en phase gazeuse.
Les monohalogénures TeX existent en tellure uniquement avec de l'iode sous forme d'iodure de tellure TeI. Il s'agit du seul mono-iodure de chalcogènes thermiquement stable et d'un solide cristallin foncé connu. Le tellure présent dans ce composé présente un état d'oxydation inhabituel + I.
Les subhalogénures contiennent du Te dont l'état d'oxydation est inférieur à + I. Les représentants stables sont Te2I, Te2Br et Te3Cl2.
Les hexahalogénures TeX6 dont le tellure est à l'état d'oxydation + VI ne sont connus que sous le nom d'hexafluorure de tellure TeF6 ou de chlorure de pentafluorure de tellure TeF5Cl. Les deux sont des gaz incolores. L'hexafluorure de tellure est l'hexafluorure de chalcogène le plus réactif (à l'exception de l'hexafluorure de soufre SF6 et de l'hexafluorure de sélénium SeF6) et est le seul à être hydrolysé dans l'eau.
En outre, le tellure à l'état d'oxydation + IV en solution aqueuse contient également des composés complexes [TeX6] 2- (X = F-, Cl-, Br-, I-) avec tous les ions halogénure. À l'exception du complexe hexafluoro, tous les autres ont une structure parfaitement octaédrique et peuvent également être précipités sous forme de sels de solution (par exemple, hexachloridotellurate d'ammonium jaune (IV) (NH4) 2 [TeCl6], hexabromidotellurate d'ammonium rouge brun (IV), (NH4) 2 [TeBr6] ou hexaiodidotellurate de césium noir (IV) Cs2 [TeI6]).
connexions organotellure
Le tellure forme une série de composés organométalliques. Cependant, ils sont très instables et peu utilisés en synthèse organique. En tant que composés organiques de tellure purs de la forme R2Te, R2Te2, R4Te et R6Te (R sont chacun alkyle, aryle) sont connus.
De plus, les dihalogénures de diorganotellure R2TeX2 (R = alkyle, aryle; X = F, Cl, Br, I) et les triorganotellurururides R3TeX (R = alkyle, aryle, X = F, Cl, Br, I) sont également connus.
Tellurpolykationen
Polycation te72+ à Te7[Be2Cl6]
En oxydant soigneusement le tellure, en plus du Te42 + déjà mentionné, de nombreux polycations de tellure Tenx + peuvent être préparés et cristallisés avec un contre-ion approprié. Le contre-ion doit être une base de Lewis faible, car les polycations au tellure sont des acides de Lewis relativement forts. Les agents oxydants appropriés sont souvent des halogénures des métaux de transition qui, à des températures typiquement de 200 ° C, donnent directement le composé souhaité:
Souvent, la cristallisation est réussie dans les conditions du transport chimique, mais il faut parfois utiliser des solvants anhydres tels que le chlorure stannique ou le tétrabromure de silicium. Dans certains cas, les sels fondus sont également des milieux de réaction appropriés Si l'halogénure de métal n'est pas un agent oxydant approprié, comme c'est généralement le cas pour les halogénures des éléments du groupe principal, les tétrahalogénures de tellure correspondants peuvent être utilisés comme agents oxydants:
En faisant varier le contre-ion et le milieu réactionnel, une grande variété de polycations pourrait être représentée; Les polycations mixtes sélénium-tellure sont également accessibles par un choix approprié des réactifs de la synthèse. Outre les polycations en forme de chaîne ou de bande représentées, il existe également des polycations isolées telles que Te62 +, Te64 + et Te84 +.
Prix du tellure
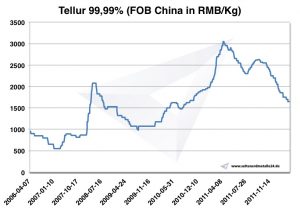
Carte Tellurium 2006-2011
Prix du tellure -> prix des métaux stratégiques











![{\ mathrm {13 \ Te \ + \ TeCl_ {4} \ + \ 4 \ BeCl_ {2} \ longrightarrow \ 2 \ Te_ {7} [Be_ {2} Cl_ {6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1d391160b6e1fdb357b4a11ea7abd720a1cb0ba)
