Chrome, Cr, numéro atomique 24
Chrome - Extraction, utilisation, prix du chrome
général
Le chrome (alt. Χρῶμα chrṓma, couleur ') est un élément chimique dont le symbole est Cr et le numéro atomique 24. Il appartient aux métaux de transition, dans le tableau périodique, il est dans le 6. Sous-groupe (groupe 6) ou groupe chrome. Les composés du chrome ont de nombreuses couleurs différentes et sont souvent utilisés comme pigments dans les peintures et les vernis.
Récupération
Le minerai de chromite extrait est libéré de la roche morte. Dans la deuxième étape, une digestion oxydante a lieu à environ 1200 ° C pour donner le chromate:
Le chromate de sodium est extrait à l'eau chaude et transformé en bichromate avec de l'acide sulfurique:
Le dichromate de sodium cristallise lors du refroidissement sous forme de dihydrate de la solution. Une réduction ultérieure avec du carbone donne l'oxyde de chrome (III):
Ceci est suivi par la réduction aluminothermique de l'oxyde de chrome (III) en chrome:
Le chrome ne peut pas être obtenu à partir de minerais oxydés par réduction au charbon, car cela crée du carbure de chrome. Le chrome plus pur est produit par électrodéposition du Cr3+Les ions de la solution d'acide sulfurique sont montrés. Les solutions correspondantes sont préparées en dissolvant de l'oxyde de chrome (III) ou du ferrochrome dans de l'acide sulfurique. Cependant, le ferrochrome en tant que matériau de départ nécessite une séparation préalable du fer.
Le chrome extrêmement pur est produit par d'autres étapes de purification utilisant le procédé van-Arkel-de-Boer.
Le ferrochrome est produit par réduction de chromite dans un four électrique à arc à 2800 ° C.
Propriétés
Le chrome est un métal dur blanc argenté, résistant à la corrosion et au ternissement, résistant, malléable et malléable dans son état d'origine. Il est antiferromagnétique avec une température Néel de 475 K. Le chrome se dissout dans l'acide chlorhydrique et l'acide sulfurique après un certain temps avec dégagement d'hydrogène lorsque la couche d'oxyde protecteur a disparu. Les niveaux d'oxydation courants du chrome sont +2, +3 et +6, +3 étant le plus persistant.
Cr (II) est d4-Configuration instable. Il n'y a pratiquement aucun autre agent réducteur qui absorbe l'oxygène de l'air aussi rapidement que Cr (II). Mais même sans admission d'air, Cr2+-Les solutions ne sont stables que pendant une courte période si elles sont obtenues à partir du chrome le plus pur (par exemple, le chrome électrolyte).
Cr3+ est la forme la plus stable. Ceci est expliqué par la théorie du champ cristallin, selon laquelle le d3 La configuration est stabilisée par une coque inférieure à moitié remplie.
Cr (VI) sous forme de chromate (CrO42-) ou bichromate (Cr2O72-) est utilisé comme agent oxydant puissant. Il est toxique et cancérigène. Dans les solutions aqueuses, il existe un équilibre chimique entre les deux ions qui dépend du pH. Si vous acidifiez une solution diluée de chromate jaune, vous donnez H.+-Ions, selon LeChatelier, l'équilibre se déplace dans le sens du bichromate, la solution vire à l'orange.

- Consignes de sécurité et signification biologique
Le rôle de Cr (III) (Cr3+Ions) dans le corps humain fait actuellement l'objet de controverses. Il y a des indications que le Cr (III) pourrait jouer un rôle dans le métabolisme des glucides et des graisses chez les mammifères. Ces informations font actuellement l'objet d'un suivi. Les indications antérieures selon lesquelles le complément alimentaire populaire Cr (III) -picolinate a un effet bénéfique sur la structure corporelle n'ont pas pu être confirmées dans des études ultérieures. Une étude sur des cellules de hamster a montré que le picolinate de Cr (III) est mutagène et peut provoquer le cancer.
Les données actuellement disponibles indiquent qu'il est extrêmement peu probable qu'il souffre d'une carence en chrome. Des doses encore plus élevées de Cr (III) déclenchent un effet toxique avec difficulté, car le produit de solubilité de l'hydroxyde de Cr (III) est extrêmement faible (6,7 x 10-31). Il est donc vraisemblablement très difficile à absorber dans l'intestin humain. Aux États-Unis, la dose recommandée de Cr (III) a été réduite de 50–200 µg / jour à 35 µg / jour chez l'homme adulte et à 25 µg / jour chez la femme adulte.
Les composés Cr (VI) sont extrêmement toxiques. Ils sont mutagènes et endommagent l'ADN. Ils pénètrent dans le corps par les voies respiratoires et endommagent les tissus pulmonaires. Les personnes exposées de façon chronique à de tels composés courent un risque accru de développer un cancer du poumon. L'effet toxique augmente avec l'insolubilité du sel. La directive RoHS limite sévèrement l'utilisation des composés Cr (VI) en Europe.
Utiliser
Le chrome et les composés de chrome sont utilisés dans une grande variété d'applications où sa durabilité est utilisée:
- chromage dur: application galvanique d'une couche de protection contre l'usure jusqu'à 1 mm d'épaisseur directement sur acier, fonte, cuivre. L'aluminium peut également être chromé après l'application d'une couche intermédiaire (cylindres en aluminium chromé dur dans la construction du moteur).
- Dekorverchromung: application galvanique d'une couche de Cr <1 μm d'épaisseur comme décoration avec une couche intermédiaire anticorrosion en nickel ou nickel-cuivre. Les pièces en plastique sont également très souvent chromées. Le procédé achrolyte est un substitut au chromage décoratif.
- passivation couches de zinc galvanique (chromatation)
- élément d'alliage: dans les aciers inoxydables et les alliages non ferreux résistants à la corrosion et à la chaleur
- Catalyseur: activer ou accélérer les réactions chimiques
- tannage au chrome: la principale méthode de fabrication du cuir
Liens
- L'oxyde de chrome
- Oxyde de chrome (III) Cr2O3, est utilisé comme peinture émail et pour colorer le verre (bouteilles vertes) (également vert pont de Cologne). Cela ne doit pas être confondu avec le vert de chrome toxique.
- jaune de chrome
- Chromate de plomb (II) PbCrO4, utilisé pour servir de pigment de couleur jaune brillant ("Post yellow"). En raison de sa toxicité, il est maintenant presque complètement remplacé par des pigments de couleur organiques. En analyse, il est utilisé pour la détermination iodométrique du plomb.
Le jaune de chrome, qui est utilisé comme peinture d'artiste, est un sulfate de plomb / chromate de plomb (environ 2 PbSO4 · PbCrO4). Le pigment a été découvert par Louis-Nicolas Vauquelin en 1809 et est produit commercialement en Allemagne depuis 1820. Le jaune chrome a un pouvoir couvrant élevé, sa stabilité à la lumière dépend du ton jaune. Le jaune de chrome est rarement utilisé dans la peinture à l'huile. Vincent van Gogh a cependant utilisé du jaune de chrome a. une. dans les célèbres peintures de tournesol exécutées à l'huile sur toile. Aujourd'hui, cependant, certains d'entre eux souffrent de décoloration des tons jaunes.
Le technologue en art, le professeur Christoph Krekel de l'Académie des arts de Stuttgart, sur l'utilisation du pigment jaune de chrome: "Les peintres sont tombés sur le jaune chrome, parce que c'est un jaune très brillant - il a une grande intensité de couleur, c'est-à-dire que vous pouvez créer une peinture beaucoup plus lumineuse à l'aide de cette nouvelle teinte jaune".
Le jaune chrome est également une couleur importante dans l'analyse de la contrefaçon de peintures "anciennes".
- du dioxyde de chrome
- Oxyde de chrome (IV) CrO2, est une poudre ferromagnétique noire pour la production de bandes magnétiques avec un meilleur rapport signal / bruit que les bandes magnétiques d'oxyde de fer conventionnelles car le dioxyde de chrome a une coercivité plus élevée.
- l'acide chromique
- avec la structure hypothétique H2CrO4 n'existe qu'en solution aqueuse diluée. C'est très toxique. Il existe sous forme d'anion dans certains chromates et bichromates.
L'anhydride d'acide chromique, l'oxyde de chrome (VI) très toxique CrO3, est connu sous le nom de trioxyde de chrome.
Le bichromate de potassium K orange, très toxique2Cr2O7 est un agent oxydant puissant: dans une solution d'acide sulfurique, les alcools primaires sont facilement convertis en aldéhydes appropriés, qui peuvent être utilisés pour la détection semi-quantitative d'alcool dans l'haleine. Dans la zone du laboratoire, c'était sous la forme de l'acide chromique utilisé pour le nettoyage de la verrerie. Au contact des ions chlorures, toutefois, les substances volatiles, cancérogènes chromyle CrO2Cl2 formé (déduction!). Le bichromate de potassium est également utilisé comme titrant et comme fixateur dans les bains de teinture industriels. Le bichromate de potassium et le également très toxique dichromate d'ammonium (NH4)2Cr2O7 sont la substance sensible à la lumière dans les couches de gélatine de chrome des premières photographies (voir le processus d'impression fine).
- chromite
- (Brique en fer chromé, voir ci-dessus) FeCr2O4 est utilisé pour fabriquer des moules pour brûler des briques.
Prix du chrome, graphiques et données historiques
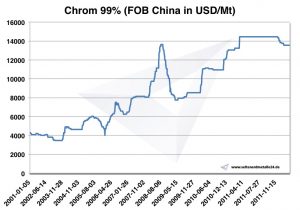
Graphique Chrome 2001-2011








 = 3,1 10-4)
= 3,1 10-4)


