Silicium, Si, numéro atomique 14
Prix, occurrence, extraction et utilisation du silicium
Le silicium, également le silicium, est un élément chimique avec le symbole Si et le numéro atomique 14. C'est dans le 4. Groupe principal (groupe carbone) ou le 14. Groupe IUPAC et le 3. Période du tableau périodique des éléments. En termes de fraction massique (ppmw), il s'agit du deuxième élément le plus abondant dans la coquille terrestre après l'oxygène.
Le silicium est un semi-métal classique, il possède donc à la fois des propriétés de métaux et de non-métaux et est un semi-conducteur élémentaire. Le silicium élémentaire pur a une couleur gris-noir et un éclat typiquement métallique, souvent du bronze au bleuâtre.
Le silicium est extrêmement important pour l’électronique et, dans la mesure où 2018 sous forme purement isotopique sert également à la définition du kilogramme. Le silicium élémentaire est non toxique pour le corps humain, le silicium sous forme de silicate lié est important pour l'homme. Le corps humain contient environ 20 en mg / kg de masse corporelle de silicium; le montant diminue avec l'âge.
Orthographe et étymologie
Par défaut, l'élément 'silicium' est écrit. La notation avec, c 'est principalement utilisée dans le jargon chimique. Les deux orthographes ont pour origine le terme latin silice, silice ', associé à silex latin' galet ',' rock '.
Le mot anglais pour le silicium est le silicium. Il est inclus, par exemple, dans le nom Silicon Valley. La traduction occasionnelle du silicone est un faux ami, car les silicones sont une classe de composés chimiques du silicium.
Histoire
Utilisation en période préindustrielle
Les composés de silicium, en particulier les roches, ont traditionnellement joué un rôle important dans l'histoire de l'humanité en tant que matériau de construction. Stonehenge est un exemple typique de structure en pierre ancienne. Un autre matériau siliceux important qui a longtemps été utilisé comme matériau de construction est le terreau, qui a été initialement utilisé dans la construction en argile à fibres ramifiées, plus tard sous forme de briques. Le ciment, qui contient aussi du silicate, a été développé pour la première fois par les Romains.
En raison de leurs arêtes vives, les roches siliceuses ont également été utilisées comme outils à l'âge de pierre. L'obsidienne, par exemple, était déjà exploitée comme matériau d'outils particulièrement adapté à l'époque protohistorique et largement diffusée dans le commerce. Feuerstein était exploité dans des régions calcaires, telles que la Belgique et le Danemark. Dans l'extraction des métaux, en particulier dans la fabrication de l'acier, les scories de silicate sont utilisées pour protéger les poêles et les fours de l'entrée d'oxygène et sous forme de moisissures d'argile ou de sable; peut-être que la fabrication du verre a été découverte.
Découverte en tant qu'élément
Pour la première fois de l'année, 1789 Antoine Lavoisier prédit que Silex est l'oxyde d'un métal. En l'an 1807, Humphry Davy a postulé des tests électrochimiques pour déterminer l'existence des métaux silicium, aluminium, zirconium et glucinium (béryllium).
"Si j'avais eu la chance d'obtenir ce sujet et d'avoir obtenu les substances métalliques que j'étais à la recherche, j'aurais proposé les noms de silicium, d'alumium, de zirconium et de glucium."
"Si j'avais été si heureux d'avoir des preuves plus fiables sur le sujet et d'avoir enseigné les substances métalliques que je recherchais, j'aurais suggéré les noms de silicium, d'alumium, de zirconium et de glucium."
- Humphry Davy
Dans 1811, le chimiste Joseph Louis Gay-Lussac et Louis Jacques Thénard (cf. Thénards Blau) ont produit du silicium impur et amorphe (a-Si, la forme non cristalline du silicium allotropique). Pour ce faire, ils ont fait réagir du tétrafluorure de silicium avec du potassium élémentaire. Une procédure similaire a été suivie par Xnumx de Jöns Jakob Berzelius en Suède en faisant réagir un hexafluorosilicate avec du potassium élémentaire. Berzelius a nettoyé le silicium amorphe résultant par lavage. Il fut le premier à reconnaître la nature élémentaire du silicium et lui donna son nom.
Le terme silicium est dérivé du mot latin silex (galet, silex). Il exprime que le silicium est plus commun dans beaucoup de minéraux.
Le terme anglais silicon a été proposé à 1817 par le chimiste écossais Thomas Thomson (1773-1852). La fin -on est destinée à indiquer la relation chimique avec le carbone non carbonique (carbone) et le bore (bore).
La première production de silicium cristallin pur de l'année 1854 a été transmise au chimiste français Henri Etienne Sainte-Claire Deville par électrolyse.
Occurrence
La totalité de la Terre représente environ 15 en masse de silicium; en particulier, le manteau est composé dans une large mesure de fonte silicatée. La croûte terrestre représente environ 25,8 pour cent en poids de silicium; cela en fait le deuxième élément chimique le plus abondant après l'oxygène. Ici, le silicium se présente essentiellement sous forme de minéraux silicatés ou de silice pure.
Le sable est donc principalement constitué de silice. Le quartz est de la silice pure. De nombreuses gemmes sont constituées de dioxyde de silicium et de mélanges plus ou moins d'autres substances, telles que l'améthyste, le quartz rose, la fumée, l'agate, le jaspe et l'opale. Le silicium forme des silicates avec de nombreux métaux. Des exemples de roches siliceuses sont le mica, l’amiante, l’argile, le schiste, le feldspath et le grès. Les océans représentent également un énorme réservoir de silicium: sous forme d'acide silicique monomère, il se dissout en quantités considérables dans tous les océans. Au total (à partir de: 2011), les minéraux de silicium 1437 sont connus, le rare moissanite ayant une teneur allant jusqu'à 70 ayant la teneur en silicium la plus élevée (à titre de comparaison: le quartz minéral a une teneur en silicium allant jusqu'à 46,7).
Puisque le silicium existe aussi dans la nature, c'est-à-dire sous sa forme élémentaire, il est reconnu par l'Association internationale des minéraux (IMA) en tant que minéral et fait partie de la classification de Strunz'schen Mineral (édition 9) sous le système no. 1.CB.15 (édition 8: I / B.05-10) en tête du département des semi-métaux et des non-métaux. Dans la classification anglo-saxonne la plus connue de la langue anglaise selon Dana, l'élément minéral porte le système no. 01.03.07.01.
Du silicium solide a été détecté (2011) sur des sites 15, notamment pour la première fois dans le gisement de Nuevo Potosí à Cuba. D'autres localités se trouvent en République populaire de Chine, en Russie, en Turquie et aux États-Unis.
Silicatkreislauf
Les minéraux silicatés sont définitivement dégradés par réaction avec l'acide carbonique de l'eau pour former de l'acide métasilicique et des carbonates, comme le montre l'exemple du silicate de calcium:
L'acide métasilicique insoluble réagit en outre avec l'acide carbonique pour former de l'acide orthosilicique soluble:
Cependant, l'acide orthosilicique réagit à nouveau relativement rapidement avec lui-même au dioxyde de silicium (amorphe) et à l'eau, à condition que le pH soit ≥ 3. La concentration absolue d'acide orthosilicique est relativement faible (par exemple <environ 7 mmol dans l'eau de mer).
L'incorporation de silice ou de silicates solubles dans l'eau dans des organismes marins (1.), Qui sédimentent après l'extinction après avoir été noyés, ou par un volcanisme et une fuite de magma sur le fond marin régresse les minéraux silicatés (2.). Et le cycle est fermé:
L'horizon temporel dans lequel se déroule ce processus est de plusieurs millions d'années. Il est donc considérablement plus long que dans le cas du cycle du carbone de la nature vivante.
Silicium dans la nature vivante
Outre la nature essentielle déjà mentionnée du silicium, de nombreux organismes produisent des structures contenant du dioxyde de silicium. Les plus connus d'entre eux sont les diatomées, les éponges (Porifera, Spongiaria) et les radiolaires, qui forment un exosquelette de dioxyde de silicium par condensation de l'acide orthosilicique Si (OH) 4 catalysée par des enzymes. De nombreuses plantes contiennent également de la silice dans leurs tiges et leurs feuilles. Des exemples bien connus ici sont la prêle et le bambou. La dorsale en silice construite leur confère une stabilité supplémentaire.
Signification physiologique pour l'homme
Le silicium semble être nécessaire à la formation et à la maturation des os. Chez les veaux, l’administration d’orthosilicate a entraîné la prolifération de collagène dans la peau et le cartilage. L'apport souhaitable provenant d'expérimentations animales est de 30 mg / j. Les carences chez l'homme ne sont pas encore connues.
La silice ou la silice terra sont des produits oraux. Essentiellement, ils contiennent des anhydrides siliciques (dioxyde de silicium) et sont censés renforcer la peau, les ongles, les os et le tissu conjonctif et les maintenir en bonne santé. Un effet n'a pas été scientifiquement prouvé.
Un excès de silicium peut provoquer une hémolyse des érythrocytes et, par conséquent, des modifications cellulaires.
Extraction en laboratoire
Le silicium élémentaire peut être obtenu en laboratoire par réduction, à partir de silice ou de tétrafluorure de silicium, avec des métaux de base. La réaction 2.) Est un procédé aluminothermique, qui fonctionne uniquement avec l’addition de soufre élémentaire, la troisième voie correspond à la découverte de l’élément:
Le silicium amorphe hautement réactif peut être obtenu par réduction avec du sodium ou acidolyse de siliciures:
Extraction dans l'industrie
Le silicium élémentaire est utilisé à différents degrés de pureté en métallurgie (ferrosilicium), en photovoltaïque (cellules solaires) et en microélectronique (semi-conducteurs, puces informatiques). En conséquence, il est courant dans l'industrie de classer le silicium élémentaire en fonction de différents degrés de pureté. Une distinction est faite entre simg (qualité métallurgique, silicium brut, 98-99% pureté), sisg (qualité solaire, silicium solaire, impuretés inférieures à 0,01%) et victoire (électronique, silicium semi-conducteur, impuretés de petite taille 10-9). Pour les cellules solaires, la pureté du matériau sur toute son épaisseur est importante pour assurer la durée de vie du support la plus longue possible. Pour de nombreuses applications en microélectronique, seules les couches supérieures d’environ 20 à 30 microns doivent être extrêmement pures.
Traditionnellement, on utilise le procédé Siemens dans lequel on fait d'abord réagir le silicium avec du chlorure d'hydrogène gazeux à 300-350 ° C dans un réacteur à lit fluidisé pour obtenir du trichlorosilane (silicochloroforme).
Après plusieurs étapes de distillation, le trichlorosilane est décomposé thermiquement en présence d'hydrogène lors d'une inversion de la réaction ci-dessus sur des barreaux de silicium hyperpure chauffés à 1000-1200 ° C. Le silicium élémentaire se développe sur les tiges. Le chlorure d'hydrogène libéré est renvoyé dans la circulation. En tant que sous-produit, le tétrachlorure de silicium précipite, qui est soit converti en trichlorosilane et renvoyé dans le processus, soit brûlé dans la flamme de l'oxygène en silice pyrogénée. Le procédé Siemens produit 19 kg de déchets et de sous-produits par kg de silicium hyper-pur.
silicium brut
A l'échelle industrielle, le silicium élémentaire est obtenu par réduction de la silice avec du carbone dans le four de réduction par fusion à des températures d'environ 2000 ° C. Le matériau de départ est du sable de quartz ou du gravier de quartz.
2002 a produit environ 4,1 millions de tonnes de ce silicium brut industriel (Simg). Suffisamment propre pour les besoins de la métallurgie, il est utilisé comme constituant d'alliage et désoxydant pour les aciers (amélioration de la résistance à la corrosion, suppression de la cémentite) et comme matière première pour la production de silane par le procédé de Müller-Rochow, principalement pour la production de silicones. Pour la production de ferrosilicium pour l'industrie sidérurgique (désoxydant dans le procédé de haut fourneau), la réaction ultérieure est effectuée de manière appropriée en présence de fer élémentaire.
Les autres possibilités de digestion de SiO2 sont:
La digestion de la soude à environ 1600 ° C dans la cuve de fusion:
La digestion hydrothermale à environ 200 ° C avec de l’eau dans un autoclave:
silicium solaire
Pour la production de cellules solaires, le silicium brut doit être encore purifié au silicium solaire (Sisg). Il existe différentes procédures pour cela. Ces méthodes représentent la partie la plus énergivore de la production de modules solaires en raison des nombreuses étapes intermédiaires complexes. Par conséquent, divers procédés de fabrication tels que la méthode UMG (grade métallurgique amélioré) et la méthode FBR (réacteur à lit fluidisé) sont maintenant testés et utilisés.
Une alternative sans chlore est la décomposition du monosilane, qui se décompose à nouveau après une étape de nettoyage sur des surfaces chauffées ou lors du passage dans des réacteurs à lit fluidisé.
Le silicium polycristallin (polysilicium) ainsi obtenu convient à la fabrication de modules solaires et présente une pureté supérieure à 99,99%. En technologie solaire, comme en microélectronique, les propriétés semi-conductrices du silicium sont exploitées.
Un procédé qui était auparavant utilisé par la société DuPont était d’intérêt historique. Elle était basée sur la réduction du tétrachlorosilane avec de la vapeur de zinc élémentaire à des températures de 950 ° C.
En raison de problèmes techniques et de la grande quantité de déchets de chlorure de zinc, ce procédé n'est plus utilisé aujourd'hui.
silicium semi-conducteur
Silicium semi-conducteur monocristallin
Pour les applications en microélectronique, le silicium monocristallin (Sieg) de haute pureté est nécessaire. En particulier, les contaminations avec des éléments qui conviennent également comme éléments dopants doivent être portées à des concentrations inférieures à certaines valeurs critiques par tirage au creuset ou fusion par zone. Le fabricant Shin-Etsu annonce une référence "11N" (= 99,999 999 999%) de ses lingots.
Lors du tirage de creusets (procédé Czochralski), le silicium solaire obtenu dans le procédé Siemens est fondu dans des creusets en quartz. Un cristal germe de silicium monocristallin de haute pureté est placé dans cette masse fondue et retiré lentement de la masse fondue tout en centrifugeant pour cristalliser du silicium de haute pureté sous forme monocristalline sur le cristal, laissant presque tous les contaminants dans la masse fondue. Le fond physique de ce processus de purification est la dépression du point de fusion et la tendance des substances à cristalliser le plus pur possible.
En variante, lors de la fusion d'une zone à l'aide d'un appareil de chauffage électrique à induction (en forme d'anneau), une zone fondue passe à travers une tige de silicium, de sorte qu'une grande partie des contaminants se dissolvent dans la masse fondue et migrent avec elle.
Le silicium cristallin de haute pureté est actuellement le matériau de base le plus approprié pour la microélectronique; moins en ce qui concerne ses propriétés électriques qu'en raison des propriétés chimiques, physiques et techniques du silicium et de ses composés (dioxyde de silicium, nitrure de silicium, etc.). Toutes les puces informatiques, mémoires, transistors, etc. courants utilisent du silicium de haute pureté comme matériau de départ. Ces applications sont basées sur le fait que le silicium est un semi-conducteur. Grâce à l'incorporation ciblée d'impuretés (dopage), telles que l'indium, l'antimoine, l'arsenic, le bore ou le phosphore, les propriétés électriques du silicium peuvent varier dans une large plage. Surtout, au moyen des effets de jonction PN ainsi générés, il est possible de réaliser une variété de circuits électroniques. En raison de l'importance croissante des circuits électroniques, on parle également de l'âge du silicium. Le nom de la Silicon Valley pour la région de haute technologie en Californie souligne également l'énorme importance du silicium dans les industries des semi-conducteurs et de l'informatique.
Le silicium amorphe peut être converti en silicium polycristallin en utilisant des lasers à excimères. Cela revêt une importance croissante pour la fabrication de transistors à couches minces (TFT) destinés aux écrans plats.
plaquette de silicium
Le silicium est disponible dans le commerce à la fois sous forme de poudre à grain fin et en morceaux plus gros. Le silicium de haute pureté destiné à être utilisé dans des modules solaires ou des composants semi-conducteurs est généralement produit sous la forme de disques minces de monocristaux, appelés tranches de silicium (voir Fig.). Toutefois, en raison des investissements initiaux élevés et des longs délais de construction des fours nécessaires, seules quelques entreprises dans le monde produisent du silicium brut.
Les plus grands producteurs de silicium métallurgique sont:
- Elkem (N, USA)
- Invensil (F, USA)
- Globe Metallurgical (Etats-Unis)
- Rima Metal (Br)
Il y a environ 15 d'autres gros producteurs. La République populaire de Chine compte un certain nombre de petites œuvres qui en font le plus gros producteur du pays.
Le marché du polysilicium et du silicium hyperpuré est en transition depuis le milieu des 2000. En raison de la forte demande de l'industrie solaire, 2006 a connu une pénurie de silicium.
Propriétés physiques
Le silicium, comme le germanium, le gallium, le phosphore et l’antimoine adjacents au tableau périodique des éléments, est un semi-conducteur élémentaire. La distance énergétique entre la bande de valence et la bande de conduction selon le modèle de bande est 1,107 eV (à la température ambiante). En dopant avec des éléments dopants appropriés tels que le bore ou l'arsenic, la conductivité peut être multipliée par un facteur 106. Dans le silicium ainsi dopé, la ligne d'impuretés provoquée par les impuretés et les défauts du réseau est nettement plus grande que celle de la ligne intrinsèque, raison pour laquelle de tels matériaux sont appelés semi-conducteurs d'impuretés. Le paramètre de grille est 543 pm.
Spectre de l'indice de réfraction complexe (N = n + ik) du silicium
L'indice de réfraction complexe, qui dépend de la longueur d'onde de la lumière, est indiqué sur l'image ci-contre. Ici aussi, des informations sur la structure de bande peuvent être lues. Une transition de bande directe à 370 nm (EÀ1 = 3,4 eV) peut être observée sur la base de l'évolution fortement croissante du coefficient d'extinction k. Une autre transition de bande directe peut être observée à ≈ 300 nm (EΓ2 = 4,2 eV). La transition de bande indirecte du silicium (Eg = 1,1 eV) ne peut être estimée qu'à. Le fait qu'il existe des transitions de bande indirectes supplémentaires peut être vu à partir de la large courbe de k pour les longueurs d'onde> 400 nm.
Comme l’eau et quelques autres substances, le silicium présente une anomalie de densité: sa densité sous forme liquide (à Tm = 1685 K) est plus élevée de 10-11% que sous forme solide, cristalline (c-Si) de 300 K.
Propriétés chimiques
Dans la nature et dans la grande majorité des composés synthétiques, le silicium forme exclusivement des liaisons simples. La stabilité de la liaison simple Si-O par opposition à la liaison double CO est due à son caractère de double liaison partielle, qui résulte du chevauchement des paires isolées d'oxygène avec les orbitales vides de silicium. La règle de la double liaison, considérée depuis longtemps comme valide, selon laquelle le silicium est un élément du 3. Cependant, entre-temps, il est devenu obsolète puisqu’un grand nombre de composés synthétiques avec des doubles liaisons Si-Si sont maintenant connus. Dans 2004, le premier composé avec une triple liaison formelle Si-Si a été caractérisé structurellement.
À l'exception de l'acide fluorhydrique contenant de l'acide nitrique (dans lequel de l'hexafluorosilicate est formé), le silicium est insoluble dans les acides car la passivation se produit par la formation d'une couche de silice solide. D'autre part, il se dissout facilement dans les alcalis caustiques chauds avec formation d'hydrogène. Malgré son potentiel normal négatif (-0,81 V), il est relativement inerte sous sa forme compacte, car il se recouvre d'une couche d'oxyde protectrice dans l'air.
Propriétés mécaniques
Les propriétés mécaniques du silicium sont anisotropes (directionnelles). En fonction de l'orientation des cristaux sélectionnée, le module d'élasticité prend des valeurs comprises entre 130 GPa et 189 GPa. Une description générale du comportement élastique est donnée en notation Voigt comme pour tous les cristaux cubiques via les trois constantes élastiques indépendantes C11, C12 et C44. La matrice d'élasticité est pour le silicium:
Les constantes élastiques ont les valeurs suivantes:
Les modules élastiques respectifs peuvent être calculés à partir des constantes élastiques pour les différentes directions cristallines principales du silicium (100,110 et 111):
isotope
Il existe un total d'isotopes 23 entre 22Si et 45Si de silicium connus. Trois d'entre eux, les isotopes 28Si, 29Si et 30Si, sont stables et naturels. L'isotope avec la plus grande part de la composition isotopique naturelle est 28Si avec 92,223%, 29Si a une part de 4,685% et 30Si de 3,092%. Les isotopes instables dont la durée de vie est la plus longue sont 32Si, qui se transforme en 153P (phosphore) avec une demi-vie d'années 32 sous désintégration bêta, et 31Si, qui se désintègre également en 157,36P sous une désintégration bêta d'une demi-vie de minutes 31. Tous les autres isotopes n'ont qu'une demi-vie de quelques secondes ou millisecondes.
28Si se forme en grande quantité dans les étoiles lourdes vers la fin de leur développement (combustion de l'oxygène). C'est la raison de la forte proportion de 28Si dans le silicium total (92,23%) ainsi que dans la fréquence du silicium par rapport aux autres éléments. Depuis 2009, des tentatives ont été faites pour redéfinir le kilogramme d'unité de base SI en un ensemble donné d'atomes 28Si; Ces tentatives ont conduit 2018 à une nouvelle définition en novembre. Les isotopes 29Si (% 4,67 du silicium total) et 30Si (3,1%) sont également stables.
L'isotope radioactif 31Si se désintègre rapidement (minutes 157,3 en demi-vie) par rayonnement bêta en phosphore stable. Cette circonstance peut être utilisée pour produire du silicium dopé n de manière très homogène. À cette fin, le silicium est irradié avec des neutrons. Par capture de neutrons, 31Si et donc 31P apparaissent. Une source de neutrons appropriée pour cette méthode est la source de neutrons de recherche Heinz Maier-Leibnitz. Plus durable est 32Si avec une demi-vie de 172 années. Des traces de cet isotope se forment dans l'atmosphère terrestre par spallation d'argon par rayonnement cosmique. 32Si se désintègre en 32P également radioactif (demi-vie de 14,3 jours), puis en 32S (soufre) stable. Tous les autres isotopes se désintègrent en quelques secondes.
Sécurité
Le silicium est une poudre combustible qui ressemble à de nombreux éléments. Sous forme de poudre et de granulés, il est irritant. Le silicium compact est inoffensif.
Le silicium poreux hydrogéné, c'est-à-dire recouvert superficiellement d'hydrogène, peut être très explosif sous irradiation laser et augmenter l'oxygène, comme l'ont découvert par hasard des chercheurs de l'Université technique de Munich. Le dynamitage au micromètre est possible. La vitesse de détonation et l'énergie de détonation sont supérieures à celles du TNT et de la dynamite.
Utilisation en technologie
1947 a découvert John Bardeen, Walter Brattain et William Shockley, la résistance électrique contrôlable, le transistor, d'abord sur un monocristal de germanium. Le silicium joyeux de la connexion n'a pu être isolé que plus tard dans la pureté nécessaire aux fins de l'électronique. 1958 Robert Noyce de Fairchild et Jack S. Kilby de Texas Instruments ont indépendamment développé le circuit intégré sur une puce de silicium. Depuis environ 1970, le silicium est le matériau de base de la plupart des produits semi-conducteurs et constitue le matériau de base de nombreux capteurs et autres systèmes micromécaniques (par exemple, un bras de levier dans un microscope à force atomique). Le silicium est également le composant élémentaire de la plupart des cellules solaires.
En novembre, 2005 a été informé des premiers résultats prometteurs avec les lasers au silicium.
Le silicium est utilisé comme combustible à haute énergie dans de nombreux explosifs.
Comme le silicium se dilate lors de la solidification, alors que la plupart des substances se contractent, il est ajouté à de nombreux alliages moulés. Par exemple, la fonte contient toujours environ 2% Si. Les alliages aluminium-silicium dans lesquels la teneur en Si peut atteindre jusqu'à 20% revêtent une importance particulière. C'est la variété la plus importante de tous les matériaux en aluminium moulé.
Liens
Le silicium est presque toujours tétravalent dans les composés chimiques. En conséquence, l'atome de silicium dans les composés est généralement à quatre coordonnées. De plus, il existe maintenant un certain nombre de composés dans lesquels le silicium a une coordination cinq ou six fois. En plus du silicium tétravalent et des composés de silicium divalent (silylène) préparés par synthèse, il est connu, mais la plupart sont très instables. Le monoxyde de silicium, utilisé comme matériau pour la compensation des lentilles optiques, revêt une plus grande importance. En outre, 2012 a également détecté de manière expérimentale un composé à trois coordonnées semblable à la structure unidimensionnelle du graphène, appelée silicium.
Toute la chimie du silicium est essentiellement caractérisée par la forte affinité du silicium pour l'oxygène. Le silicium est généralement le partenaire électropositif d'un composé chimique, bien qu'il existe également des composés avec du silicium formellement annulé. Ce sont principalement des siliciures où le silicium peut également former de vrais anions.
![]()
Inversion de la polarité de liaison
Il convient de noter en particulier l’inversion de la polarité des liaisons élément-hydrogène lors du passage du carbone au silicium. Ici, la différence d'électronégativité varie de + 0,45 (carbone-hydrogène) à -0,2, ce qui explique pourquoi les composés silanes ont une réactivité complètement différente de celle des hydrocarbures.
Les principaux composés de silicium peuvent être répartis dans les classes suivantes, parmi lesquelles certains représentants sont mentionnés:
Connexions binaires
- carbure de silicium
- silice
- du nitrure de silicium
- siliciures
Silicate
- Zircon et tous les autres silicates et composés d'acide silicique
les halogénures de silicium
- tétrafluorure de silicium
- Le tétrachlorure de silicium
- Trichlorosilane (silicochloroforme)
hydrures de silicium
- monosilane
- Silane
Composés de silicium organique
- Tétraméthylsilane (TMS, standard RMN)
- Méthylchlorosilanes tels que le dichlorométhylsilane (éléments de base pour les silicones)
- phénylchlorosilane
- carbosilanes
- Carbosilazane
- carbosiloxanes
Composés de silicium polymériques
- Les silicones (silicones, polyorganosiloxanes) sont formées par polymérisation et font partie des plastiques industriels les plus importants.
- Les composés polymériques silicium-oxygène trouvent une application dans de nombreux domaines; Ils servent de lubrifiants et de produits d'étanchéité dans les industries de la cosmétique et de la construction.
- Polysilanes, -carbosilanes, -carbosilazanes, -carbosiloxanes
Autre
À ce jour, il arrive souvent que le mot anglais "silicon" (pour silicium) soit faussement traduit ou prononcé dans des articles de vulgarisation scientifique ou dans des doublages de films comme "silicone". C'est ce qui s'est passé, par exemple, dans la série de science-fiction Star Trek, le thriller de James Bond, Face à la mort, ou dans la série d'animation The Simpsons. Exemple: "La forme de vie est-elle en carbone ou en silicone?"
Prix du silicium
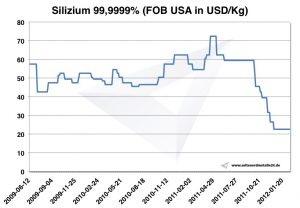
Carte silicium 2009-2012





















