Antimoine, Sb, numéro atomique 51
Prix de l'antimoine, historique, occurrence, extraction et utilisation
antimoine
Antimoine (du latin Antimonium, probablement de l'arabe "al-ithmîd (un)" est un élément chimique avec le symbole d'élément Sb (du latin Stibium, (gris) pique brillant) et le numéro atomique 51 Dans le tableau périodique, il figure dans le 5. Période et le groupe principal 5, ou 15, le groupe IUPAC ou le groupe azote Dans la modification stable, il s’agit d’un semi-métal cassant et brillant à l'argent.
Nom, histoire
On pense également que le nom remonte à la fin de l'anthemon grec (floraison allemande). L’objectif était de décrire les cristaux de sulfure d’antimoine en forme de tige, qui se présentaient sous la forme de touffes de fleurs et ressemblaient à une fleur. Dans le 11. Century se trouve le terme latin désignant l'antimoine, un médicament d'origine minérale, pour le traitement interne de maladies puis avec Constantinus Africanus.
Dans le 17. Au 19ème siècle, le nom d'antimoine était utilisé pour désigner le métal. Le terme copte pour le sulfure d'antimoine en poudre de maquillage recouvrait le grec dans le latin stibium. L'abréviation Sb utilisée par le médecin et chimiste suédois Jöns Jakob Berzelius ("père de la chimie moderne") est encore utilisée aujourd'hui comme symbole d'élément.
Une étymologie populaire légendaire tardive, immortalisée par Samuel Johnson dans son dictionnaire, indique que le moine allemand Basilius Valentinus a observé que les porcs devenaient rapidement gros en absorbant de l'antimoine. Il a également essayé cela sur ses frères, après quoi ils sont morts, cependant, de sorte que le terme "antimoine" (antimoine) ait été inventé, à partir duquel plus tard "antimoine" ait été créé.
La mine d'argent de la municipalité suédoise de Sala, dans le Västmanland, est une localité typique de l'antimoine solide. Cependant, l'antimoine métallique était déjà connue des Chinois et des Babyloniens. Certains de ses composés étaient déjà utilisés à l’âge du bronze comme supplément au cuivre pour produire du bronze (découvertes de Velem St. Vid en Hongrie).
Occurrence
L'antimoine est un élément rare. Puisqu'il peut également être trouvé dans la nature (c'est-à-dire sous forme élémentaire), il est certifié par l'Association Minéralogique Internationale (IMA) sous le système no. 1.CA.05 reconnu comme un minéral.
L’antimoine solide (2011) a été détecté dans le monde entier sur les sites 300. Ainsi, entre autres, dans plusieurs régions de l’Australie; dans les départements boliviens de La Paz et de Potosí; Minas Gerais au Brésil; Forêt noire, Fichtelgebirge, Forêt du Haut-Palatinat, Odenwald et Harz en Allemagne; Seinäjoki en Finlande; plusieurs régions de France; La Lombardie, le Piémont, la Sardaigne et le Trentin Haut Adige en Italie; certaines régions du Canada; certaines régions de l'Autriche; Sibérie orientale et occidentale et l'Oural en Russie; outre Västmanland, Dalarna, Gästrikland, Närke, Södermanland, Värmland et Västerbotten en Suède; dans certaines régions de la Slovaquie; Bohême et Moravie en République tchèque ainsi que dans de nombreuses régions des États-Unis. L'un des plus importants gisements d'antimoine solide et de minerais d'antimoine au monde est la ceinture de roches vertes de Murchison, dans la chaîne de Murchison, en Afrique du Sud.
Jusqu'ici, les minéraux d'antimoine 264 sont connus (à partir de: 2010). Le minéral sulfuré Stibnit Sb2S3 (Grauspießglanz) avec une teneur maximale de 71,7% Sb. Le minéral dont la teneur en Sb est la plus élevée est l'alliage arsenique d'antimoine naturel Paradocrasit (max 92%). Cependant, il n’a que trois localités, contrairement à Stibnit (autour des sites 2500), beaucoup moins répandu. Les autres sources d'antimoine sont les minéraux Valentinit Sb2O3 (Weißspießglanz), Breithauptit NiSb (nickel antimoine, antimonure de nickel), Kermesit Sb2S2O (shine rouge) et Sb2SXNXXXXXXXXXXXXXXXXXXXXXXXXX
Extraction et présentation
Techniquement, l'antimoine est extrait du brillant à l'antimoine. Une méthode est basée sur la torréfaction et la réduction au carbone (méthode de réduction par réduction):
Une autre possibilité consiste à effectuer la réduction avec du fer (méthode des précipitations):
Dans le monde entier étaient au début de la 21. Siècle entre 110.000 et 160.000 tonnes par an d'antimoine promu. Depuis 1900, la sortie a plus que décuplé.
87% de la production d'antimoine a lieu en Chine (à partir de: 2015).
Propriétés
L’antimoine peut se présenter sous trois modifications différentes, l’antimoine métallique ou gris étant la modification la plus consistante.
Dans des conditions normales, l’antimoine cristallise dans une configuration rhomboédrique dans le groupe d’espaces R3m (n ° 166) décrit selon le symbolisme de Hermann Mauguin avec les paramètres de réseau a = 431 pm et c = 1127 pm ainsi que six unités de formule par cellule.
En refroidissant la vapeur d'antimoine sur des surfaces froides, il se forme de l'antimoine amorphe, noir et très réactif, qui est reconverti en antimoine métallique par chauffage. La production électrolytique produit de l'antimoine explosif qui, lorsqu'il est fissuré, devient explosivement rougeoyant et produit des étincelles dans l'antimoine métallique. Cependant, cette forme contient toujours du chlore et ne peut être considérée comme une modification. L’antimoine jaune n’est pas non plus une modification indépendante, mais un composé chimique hautement polymérique avec de l’hydrogène.
Propriétés physiques
L'antimoine métallique est blanc argenté, très brillant, feuilleté-grossièrement cristallin. Il est facile à écraser en raison de sa fragilité. La conductivité électrique et thermique est faible.
Propriétés chimiques
Avec l’hydrogène naissant, l’antimoine réagit avec l’hydrure d’antimoine instable SbH3. L'air et l'eau n'attaquent pas l'antimoine à la température ambiante. Au-dessus du point de fusion, il brûle dans l'air avec une flamme blanc bleuâtre en oxyde d'antimoine (III). Il se dissout dans les acides minéraux concentrés chauds. Avec les halogènes, il réagit vigoureusement à la température ambiante avec les halogénures correspondants.
Dans les composés, l'antimoine est principalement présent dans les états d'oxydation + 3 et + 5. Dans les antimonures métalliques tels que l’antimonure de potassium K3Sb, il forme des ions Sb3.
isotope
Il existe deux isotopes stables de l'antimoine: 121Sb et 123Sb.
Utilisation et alliages
La majorité de l'antimoine produit est transformé en alliages et présente les propriétés suivantes:
Il sert à durcir les alliages de plomb et d'étain. Contrairement à la plupart des autres métaux, il se dilate lors du refroidissement de la masse fondue (en raison de la conversion en une autre modification): la teneur en antimoine peut être ajustée de manière à ce que ces alliages ne se contractent pas ou ne se dilatent pas un peu; Lorsque des pièces sont produites dans des moules de coulée, le métal presse pendant la solidification dans tous les angles et angles, de sorte que même les formes compliquées et les surfaces fortement structurées peuvent être rendues sans vide.
Alliages importants:
- Alliages plomb-antimoine: plomb dur, métal pour les lettres, métal pour roulement, plomb pour accumulateur, gaine en plomb pour câbles souterrains
- Alliages étain-antimoine: métal Britannia, métal porteur
- Production de semi-conducteurs, par exemple. B. par dopage de silicium, pour la production de semi-conducteurs composés III V
- Alliages étain-antimoine-cuivre (métal Babbit) pour métaux porteurs
- Alliages étain-antimoine-cuivre-plomb pour l'étain et autres articles en étain
soudure dite ou soudure tendre - Aluminium antimoine, gallium antimoine, indium antimoine pour dispositifs à infrarouge et à effet Hall
- Alliages d'antimoine sans retrait pour la coulée de précision
Médecine
L'antimoine (ou une préparation à base de minerai d'antimoine) se trouvait dans le 16. et 17. Devenu un «médicament phare» (iatrochimique), il était, comme d’autres médicaments paracelsiens, controversé et également interdit en France entre 1615 et 1688.
La pierre de tartre a longtemps été utilisée comme agent de réfraction (pilule d’antimoine); elle est encore parfois utilisée pour étudier le contenu de l’estomac des oiseaux.
La schistosomiase et les trypanosomes ont commencé au début de 19. Siècle avec Brechweinstein (Kaliumantimonyltartrat) se sont battus. La pierre tartare était fabriquée en conservant le vin dans une tasse à antimoine pendant un jour, puis en le buvant. En attendant, des médicaments plus efficaces et plus compatibles sont utilisés.
Les suppléments d'antimoine sont couramment utilisés comme formes pentavalentes moins toxiques pour le traitement médicamenteux de la leishmaniose et de la schistosomiase, mais ne sont plus le médicament de premier choix dans les pays développés. L'antimoine inhibe l'enzyme phosphofructokinase, étape limitante de la glycolyse.
AUTRE
- Allumette d'allumage
- Partie de détonateurs d'explosifs et de munitions au plomb.
- Trisulfure d'antimoine dans les garnitures de freins de véhicules
le sulfure d'antimoine (V): - pour la production (vulcanisation) de caoutchouc rouge (exemple: tuyaux en caoutchouc de laboratoire)
- en tant que composant rouge de la tête de tir en allumettes
- plus tôt que le maquillage des yeux et en ophtalmologie ("Augenerweiterer")
- Chromate d'antimoine en tant que pigment de couleur jaune
oxydes d'antimoine - Catalyseur pour la production de polyester et de PET (oxyde d'antimoine (III))
- comme pigment blanc pour colorer le polystyrène, le polyéthylène et le polypropylène
- Production de glaçures blanches et de frittes (porcelaine)
- Purification du verre au plomb
- dopé à l'étain en tant que revêtement conducteur transparent (oxydes d'étain antimoine "ATO"), par exemple sur des verres, pour la fabrication d'écrans ou dans des pigments électriquement conducteurs ("Minatec"), pour revêtements de sol destinés à dissiper les charges électrostatiques.
- en pigments ("Lazerflair") pour le marquage au laser de pièces en matière plastique, en raison de la forte absorption du rayonnement usuel par rayonnement laser (Nd: YAG).
- en camouflage en raison de la forte absorption infrarouge.
- en tant qu'agent ignifuge et en tant que composant de peintures ignifuges et ignifuges,
- Matières plastiques et textiles pour le gainage de câbles, housses de sièges de voitures, tissus pour rideaux, vêtements pour enfants, etc. Ä.
- Sels d'antimoine en tant que composants de pesticides, de taches et de feux d'artifice
- Diviseur pour l'or: pour la précipitation de l'argent de l'or fondu
toxicité
L'antimoine peut être fatal lors de l'ingestion de 200 à 1200 mg. En toxicologie, on connaît trois formes d'antimoine, dont l'hydrure d'hydrure d'antimoine (Stiban, SbH3) est la forme la plus dangereuse d'hémolyse massive. Après la toxicité, le tartre émétique suit avec de l’antimoine trivalent ("trivalent"), l’antimoine pentavalent étant le moins toxique.
L'antimoine trivalent est absorbé dans les globules rouges dans les deux heures qui suivent l'ingestion de 95% et est donc enrichi principalement dans les organes fortement perfusés. L'excrétion est principalement due à la liaison au glutathion par la bile avec une circulation entérohépatique élevée, et seule une petite partie est éliminée par les reins. Le tartrate d'antimonyle de potassium est excrété dans 90% le jour suivant l'ingestion, le reste étant 10% en raison d'une cinétique d'élimination plus lente au cours des jours 16.
On pense que l'antimoine, comme l'arsenic, inhibe la fonction du complexe pyruvate déshydrogénase, ce qui entraîne une déficience en adénosine triphosphate (ATP), vecteur d'énergie intracellulaire. Ceci conduit à la formation de complexes chélatants entre les groupes antimoine et thiol des enzymes correspondantes. Dans le corps, il est toxique dans de nombreux organes, notamment le tube digestif, le foie, les reins, le cœur et le système nerveux central. La plus forte concentration atteint l'antimoine dans le foie, où il peut arriver à une hépatite allant jusqu'à l'insuffisance hépatique. Au cœur, il y a des modifications de l'ECG avec inversion et réduction de l'onde T et allongement de l'intervalle QT. Une insuffisance rénale aiguë peut entraîner une hémodialyse temporaire ou permanente.
Outre les mesures d'accompagnement, telles que la thérapie par perfusion (à la fois pour compenser la perte de liquide provoquée par les vomissements et pour protéger les reins) et la surveillance étroite des signes vitaux et de l'ECG, le charbon actif, la N-acétylcystéine en tant que précurseur du glutathion, est utilisée pour l'intoxication antimicrobienne augmentation de la sécrétion et un agent chélateur, par exemple. B. Dimercaprol.
Les résultats des recherches indiquent que les composés d'antimoine irritent la peau et les muqueuses. Ces composés se dissolvent probablement dans le plastique et les textiles.
Consignes de sécurité et valeurs limites
Parmi les composés de l'antimoine, l'UE a classé le fluorure d'antimoine comme toxique (T) et les chlorures comme corrosifs (C) et dangereux pour l'environnement (N); tous les autres composés d'antimoine nocifs (Xn) et dangereux pour l'environnement (N). L'antimoine lui-même n'y figure pas. D'après la fiche de données de sécurité, il est étiqueté comme irritant.
Le Centre international de recherche sur le cancer (CIRC) classe l'oxyde d'antimoine (III) parmi les substances potentiellement cancérogènes.
Dans l’UE, l’eau potable a une limite de 5 μg / l. L'examen de jus de fruits en bouteilles de PET (pour lesquels il n'existe aucune directive) a révélé des concentrations d'antimoine allant jusqu'à 44,7 μg / L dans des concentrés de jus non dilués.
L'antimoine a été ajouté à 2016 par l'UE en vertu du règlement (CE) n ° 1907 / 2006 (REACH) dans le contexte de l'évaluation de la substance dans le plan d'action communautaire glissant (CoRAP). Il réévaluera l'impact de la substance sur la santé humaine ou l'environnement et, le cas échéant, initiera un suivi. Les principales raisons de l’absorption de l’antimoine étaient les suivantes: exposition des travailleurs, tonnage élevé (agrégé), ratio de risque élevé (RCR) et utilisation généralisée, ainsi que le risque potentiel de propriétés cancérogènes. La réévaluation a lieu depuis 2018 et est effectuée par l’Allemagne.
preuve
essais préliminaires:
Coloration de la flamme: Flamme bleu pâle, peu caractéristique Phosphorsalzperle: Incolore (perturbé par tous les éléments produisant une perle colorée)
réaction de détection:
Réduction par les métaux de base, par exemple le fer, le zinc ou l'étain.
Dans les solutions non acides, les métaux de base réduisent les cations d'antimoine Sb (III), Sb (V) et Sb (III) / (V) en antimoine métallique:
2 Sb3 + + 3 Fe → 2 Sb + 3 Fe2 +
La substance à tester pour l'antimoine est placée dans une solution d'acide chlorhydrique et mélangée à de la poudre de fer. Le résultat est un précipité noir et feuilleté d'antimoine métallique dans la solution ou directement sur le fer. La preuve d'un clou de fer est également possible. Ici, un dépôt noir sur l'ongle est une preuve d'antimoine, qui s'est déposé ici élémentaire.
L'échantillon de Marsh permet une détection claire de l'antimoine. Lorsque la substance déposée par pyrolyse (miroir brillant noir) ne se dissout pas dans le peroxyde d'hydrogène ammoniacal, l'arsenic et le germanium sont exclus en tant que solutions de remplacement possibles.
La détermination très sensible de traces infimes d'antimoine se fait par la technique de l'hydrure de spectrométrie atomique. En principe, l'échantillon de Marsh est couplé à la spectrométrie d'absorption atomique. Les effets de matrice de la solution d'échantillon peuvent être supprimés très efficacement.
Une autre méthode consiste à traiter une solution aqueuse contenant des ions d'antimoine avec une solution de rhodamine B. Il forme un complexe coloré extractible à l'éther isopropylique. Cependant, cette preuve est assez peu spécifique, car les ions or, cadmium, gallium, thallium, uranium et tungstène forment des complexes colorés.
Liens
- Antimoine hydrogène, également appelé monostiban SbH3.
- Gaz toxique formé d'antimoine et d'acides.
- Distiban (Sb2H4)
des composés halogènes
- Le fluorure d’antimoine (V) (SbF5) forme (selon VSEPR) une pyramide carrée et s’hybride à sp3d
- Chlorure d'antimoine (V) (SbCl5)
- Antimoine (III) fluorure (SbF3)
- Antimoine (III) chlorure (SbCl3)
- Bromure d'antimoine (III) (SbBr3)
- Iodure d'antimoine (III) (SbI3)
composés oxygénés
- Antimoine (III) oxyde (trioxyde d'antimoine, Sb2O3)
- Antimoine (III, V) oxyde (tétroxyde d'antimoine, Sb2O4)
- Antimoine (V) oxyde (pentaoxyde d'antimoine, Sb2O5)
- Acide antimoine / Trihydroxyde d'antimoine (H3SbO3 / Sb (OH) 3)
- Acide antimoine / Acide antimoine (III), SbOOH ou HSbO2
- Acide antimonique (HSb (OH) 6)
des composés de soufre
- Trisulfure d'antimoine, également appelé brillant à l'antimoine (Sb2S3)
Tiges métalliques brillantes gris noir. Matière première pour la production d’antimoine métallique. Soluble dans les acides forts. À utiliser pour les allumettes, les verres à friction et les peintures de camouflage (réflexion de la lumière infrarouge). - Pentasulfure d'antimoine, anciennement connu sous le nom de soufre d'or (Sb2S5)
Autres composés
- Fluorure de chlorure d'antimoine (V) (SbCl4F) (catalyseur pour la production de polytétrafluoroéthylène ("téflon"))
- Antimonide d'aluminium (AlSb)
- Antimoniure de gallium (GaSb)
- Antimoniure d'indium (InSb)
Tableau antimoine 2005-2020
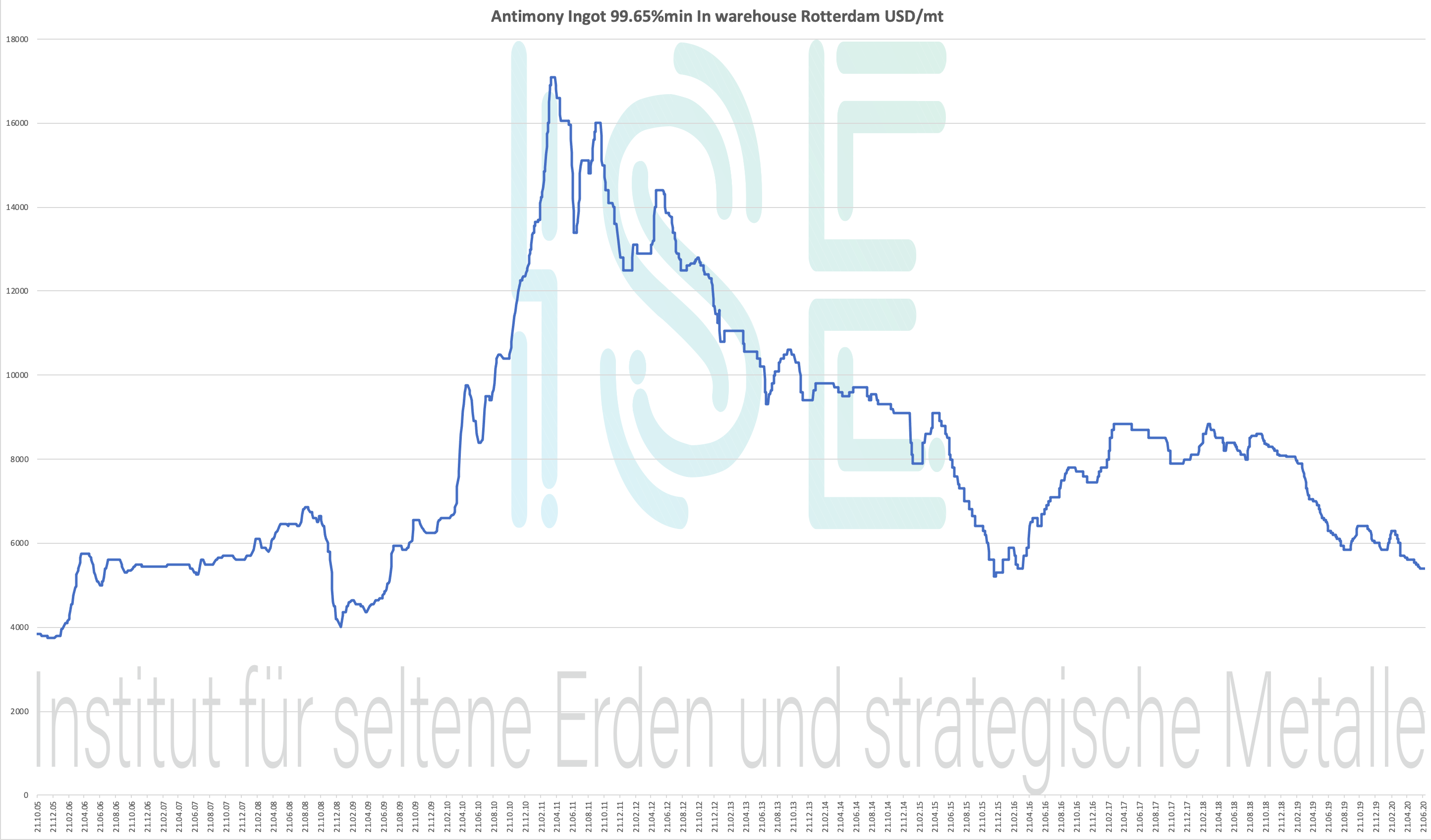
Lingot d'antimoine 99.65% min Dans l'entrepôt Rotterdam USD / mt
Tableau des prix 2004-2020 - cliquez pour agrandir
Prix de l'antimoine - Sous le prix des métaux stratégiques
Historique des prix pour le lingot d'antimoine 99,65% entrepôt Rotterdam USD / mt



