Germanium, Ge, numéro atomique 32
Prix du germanium, occurrence, extraction, utilisation
Germanium (de Germania latine 'Allemagne', après le pays dans lequel il a été trouvé pour la première fois) est un élément chimique avec le symbole d'élément Ge et le numéro atomique 32. Dans le tableau périodique, il est dans le 4. Période et dans le 4. Groupe principal (14, groupe IUPAC, bloc p et groupe carbone). C'était sur 6. Février 1886 détecté pour la première fois dans un minéral argyrodite.
Histoire
Lorsque Xnumx Dmitri Mendeleev a conçu le tableau périodique, il a découvert un espace vide sous le silicium et a postulé un élément jusqu'alors inconnu, qu'il a appelé Eka Silicium. Mendeleev a fait des prédictions sur les propriétés de l'Eka-silicium et de ses composés, qui ont cependant été rejetées par la science.
1885 a découvert que Clemens Winkler (1838-1904), chimiste à la Bergakademie Freiberg, travaillait avec le minéral argyrodite récemment découvert, sur le fait que son analyse quantitative présentait toujours un déficit d'environ 7%. Aussi souvent que l'analyse était répétée, le déficit était resté à peu près constant et Winkler a finalement deviné que le minéral contenait un élément jusqu'alors inconnu. Après quatre mois de travail, il a finalement réussi à 6. Février 1886 l'isolement d'un précipité de sulfure blanc, qui pourrait être réduit dans le flux d'hydrogène en une poudre métallique. Après la planète Neptune précédemment découverte, Winkler voulait initialement appeler le nouvel élément Neptunium. Comme ce nom avait déjà été utilisé pour un autre élément suspect, il l'a nommé d'après la découverte Germanium. Winkler a d'abord suggéré que le Germanium était le stibium d'Eka postulé par Mendeleïev, alors que Mendeleïev voulait d'abord le classer comme cadmium d'Eka plutôt que comme silicium d'Eka. Après avoir déterminé d'autres propriétés, il a été confirmé qu'il s'agissait probablement de l'élément prédit Eka-silicium. Mendeleev avait dérivé ses propriétés de son tableau périodique, de sorte que cette découverte a contribué à la reconnaissance du tableau périodique:
L'origine et l'étymologie du nom germanium pourraient également provenir d'une incompréhension sémantique liée à l'élément prédécesseur, le gallium, car il existe deux théories pour la dénomination du gallium. Après le premier, le chimiste français Paul Émile Lecoq de Boisbaudran a nommé cet élément après la Gaule, nom latin de sa France natale. Le second est également le mot latin gallus (coq) comme source du nom, qui signifie le coq ("le coq") en français. Paul Émile Lecoq de Boisbaudran aurait nommé le nouvel élément d'après son propre nom. Winkler a supposé que l'élément précédent Gallium avait été nommé d'après la nationalité de l'explorateur français. Il a donc appelé le nouvel élément chimique "Germanium" en l'honneur de son pays (Germania latine pour l'Allemagne).
Occurrence
Le germanium est répandu mais ne se produit que dans de très faibles concentrations; Valeur Clarke (= teneur moyenne dans la croûte terrestre): 1,5 g / t. Dans la nature, il se présente généralement sous forme de sulfure (thiogermanate) et se trouve souvent en tant que compagnon dans les minerais de cuivre et de zinc (schistes de cuivre de Mansfeld). Les minéraux les plus importants sont l'argyrodite 

Extraction et production
Selon USGS, la production annuelle de 2014 était estimée à 165 t, dont 120 t en Chine. Le prix de 1 kg Germanium était de 2014, environ 1.900 USD. Selon l'UE, le prix de 2003 était de 300 USD / kg et a atteint 2009 USD de 1.000.
Pour la représentation du germanium, en particulier des gaz de combustion (contient de l’oxyde de gémanium ( 

Propriétés
germanium élémentaire
Le germanium figure dans le tableau périodique des séries de semi-métaux, mais il est classé selon la définition récente en tant que semi-conducteur. Le germanium élémentaire est très fragile et très stable dans l'air à la température ambiante. Il est oxydé en oxyde de germanium (IV) (GeO2) uniquement après un fort recuit dans une atmosphère d'oxygène. GeO2 est dimorphique et est converti à 1033 ° C par la modification au rutile (CN = 6) en une structure à quartz ß (CN = 4). Sous forme de poudre, il s'agit d'un solide inflammable qui peut facilement s'enflammer par une brève exposition à une source d'inflammation et continue à brûler après son élimination. Le risque d'inflammation est d'autant plus grand que la substance est mieux répartie. Dans une forme compacte, il n'est pas inflammable. Le germanium est bivalent et tétravalent. Les composés de germanium (IV) sont les plus stables. De l'acide chlorhydrique, une solution d'hydroxyde de potassium et de l'acide sulfurique germanium dilué n'est pas attaqué. Dans les solutions alcalines de peroxyde d’hydrogène, l’acide sulfurique chaud et l’acide nitrique concentrés sont toutefois dissous pour former du dioxyde de germanium hydraté. Selon sa position dans le tableau périodique, ses propriétés chimiques sont comprises entre le silicium et l’étain.
Le germanium est l’une des rares substances possédant la propriété d’anomalie de densité. Sa densité est plus faible à l'état solide qu'à l'état liquide. Son intervalle de bande est d'environ 0,67 eV à la température ambiante.
Les plaquettes de germanium sont considérablement plus fragiles que les plaquettes de silicium.
Utiliser
électronique
En tant que semi-conducteur, le germanium sous forme de monocristal était le matériau phare du centre électronique du 20. Spécialement pour la production des premiers diodes et transistors bipolaires au germanium disponibles sur le marché jusqu’à ce qu’ils soient remplacés par du silicium. Aujourd'hui, les applications se trouvent dans la technologie haute fréquence (par exemple, le semi-conducteur composé de silicium et de germanium) et la technologie de détection (par exemple, le détecteur à rayons X). Les cellules solaires à l'arséniure de gallium (GaAs) sont parfois constituées de plaquettes de germanium. La constante de réseau du germanium est très similaire à celle de l'arséniure de gallium, de sorte que le GaAs croît par épitaxie sur des monocristaux de germanium.
Verres et fibres
Sa deuxième application principale concerne l'optique infrarouge sous forme de fenêtres et de systèmes de lentilles en germanium polycristallin ou monocristallin et de verres optiques à transmittance infrarouge, appelés verres de chalcogénure. Les applications incluent les dispositifs de vision nocturne militaires et civils ainsi que les caméras thermiques.
Les autres utilisations principales sont la production de fibres optiques et de fibres de polyester: Dans les fibres de verre modernes pour les télécommunications, le tétrachlorure de germanium est utilisé dans le dépôt chimique en phase vapeur pour générer une accumulation de dioxyde de germanium dans le coeur de la fibre interne. Cela se traduit par un indice de réfraction plus élevé dans le noyau par rapport à la gaine de fibre, le guidage des ondes lumineuses étant ainsi assuré. En chimie des polyesters, le dioxyde de germanium est utilisé comme catalyseur dans la production de certains fibres et granulats de polyester, en particulier pour les bouteilles PET recyclables (PET = polyéthylène téréphtalate).
Médecine nucléaire et technologie nucléaire
68Ge est utilisé dans le générateur de gallium 68 en tant que nucléide parent pour la production de gallium-68. De même, 68Ge est utilisé comme source pour l’étalonnage du détecteur en tomographie par émission de positrons.
Le germanium monocristallin de haute pureté est utilisé comme détecteur de rayonnement.
Germanium dans les suppléments nutritionnels
Le sesquioxyde de Bi (carboxyéthyl) germanium (Ge-132) a été présenté comme un complément alimentaire destiné à être utilisé dans diverses maladies, dont le cancer, le syndrome de fatigue chronique, l’immunodéficience, le sida, l’hypertension, l’arthrite et les allergies alimentaires. Les effets positifs sur l'évolution de la maladie n'ont pas encore été scientifiquement prouvés.
Conformément à la directive européenne 2002 / 46 / EC relative au rapprochement des législations des États membres concernant les compléments alimentaires, le germanium ne doit pas être utilisé dans les compléments alimentaires. Dans de nombreux pays de l'UE ayant déjà harmonisé leurs législations nationales, notamment l'Allemagne et l'Autriche, l'ajout de germanium en tant que source de minéraux dans les compléments alimentaires n'est donc pas autorisé.
Les autorités compétentes mettent expressément en garde contre la consommation de Ge-132, des effets graves sur la santé et des décès ne pouvant être exclus.
Usage médicinal du germanium
L’efficacité thérapeutique de la substance antinéoplasique spirogermanium dans le cancer n’a pas été démontrée. Les produits finis approuvés contenant le principe actif spirogermanium n'existent pas. En Allemagne, les préparations pharmaceutiques (préparations) contenant du germanium, à l'exception des dilutions homéopathiques de D4, sont considérées comme discutables. Leur production et leur livraison sont donc interdites. Germanium metallicum est disponible sous forme de médicaments homéopathiques. Dans le cadre de préparations homéopathiques, le lactate de di-potassium germanium est décrit.
Physiologie
Le germanium et ses composés ont une toxicité relativement faible. Des traces de germanium sont incluses dans les aliments suivants: haricots, jus de tomates, huîtres, thon et ail. Ce n’est pas un oligo-élément essentiel selon l’état de la technique. Il n'y a pas de fonction biologique connue pour le germanium. Une influence possible sur le métabolisme des glucides a été discutée. Il n’existe pas de maladies par carence en germanium.
toxicité
Dans le passé, l'intoxication au germanium chez l'homme ne s'est produite qu'après la prise de composés inorganiques du germanium en tant que complément alimentaire. Les premiers symptômes sont la perte d'appétit, la perte de poids, la fatigue et la faiblesse musculaire. Cela est suivi d'un dysfonctionnement du rein pouvant aller jusqu'à une insuffisance rénale, ce qui peut être mortel pour le patient. Une neuropathie périphérique à la suite d'une maladie est également rapportée.
Des effets indésirables neurotoxiques transitoires lors de la prise de spirogermanium au cours des essais cliniques sont rapportés. Le spirogermanium a été testé comme cytostatique au cours des années 1980. Les données d'études sur des volontaires sains ne sont pas disponibles.
Des expériences sur des animaux ont montré que le germanium présentait une faible toxicité aiguë par voie orale. Les symptômes d'une intoxication aiguë avec de fortes doses de germanium comprennent:
- Dilatation des vaisseaux sanguins (artectasie)
- Ptosis
- cyanose
- Tremblement
Enfin, la paralysie respiratoire entraîne la mort des animaux de laboratoire. Les symptômes d'intoxication chronique ou subchronique par des composés inorganiques du germanium sont les suivants:
- Une perte de poids
- Changements d'organes (masse d'organes)
- Neuropathie progressive
- lésions rénales
Les composés organiques du germanium ont présenté une toxicité plus faible, mais ont entraîné chez les animaux de laboratoire une perte de poids et une diminution du nombre de globules rouges. Les données sur les effets tératogènes du germanium sont limitées. Le germanate de sodium a été testé chez le rat comme non cancérogène.
Le mécanisme de toxicité du germanium n'est pas encore complètement compris. Cependant, des effets pathologiques spécifiques sur les mitochondries des cellules rénales et nerveuses ont été observés.
interactions
Il est également discuté si le germanium peut montrer des interactions avec le silicium dans le métabolisme osseux. Il peut bloquer l'action des diurétiques et diminuer l'activité d'un certain nombre d'enzymes, telles que les déshydrogénases. Lors d'expériences sur des animaux, des souris ont montré une durée de sommeil accrue induite par l'hexabarbital lorsqu'elles étaient en outre traitées avec des composés de germanium. Ceci suggère que l'activité du cytochrome P450 est également limitée. Il a été signalé que des composés organiques du germanium bloquaient l'enzyme de détoxification, la glutathion-S-transférase.
Biodisponibilité et métabolisme
Le germanium est facilement absorbé par l'organisme lorsqu'il est ingéré. Il est distribué dans tout le tissu corporel, en particulier dans les reins et la glande thyroïde. Contrairement aux composés inorganiques du germanium, les organogermanes ne s’accumulent pas dans le corps humain. Cependant, il existe peu d'études sur le métabolisme du germanium.
Il est essentiellement excrété dans l'urine. L'excrétion via la bile et les matières fécales a également lieu.
Liens
Germanium forme Ge (II) - u. composés de Ge (IV) plus stables, seuls quelques-uns ont une signification technique.
Parmi les halogénures de germanium, il y a aussi Ge (II) - u. Représentant Ge (IV) connu. Le tétrachlorure de germanium (GeCl4), un liquide dont le point d'ébullition est 83 ° C, se forme lors de l'exposition à l'acide chlorhydrique en oxydes de germanium et constitue un intermédiaire important dans la récupération du germanium. GeCl4 de haute pureté est utilisé dans la fabrication de fibres optiques en verre de quartz pour produire une couche d’oxyde de germanium (IV) de grande pureté à l’intérieur des fibres de quartz. Pour produire des couches de germanium de haute pureté, il est également possible d’utiliser la dismutation de l’iodure de germanium (II) pour former de l’iodure de germanium et de germanium (IV):
Les germanates sont des composés de germanium dérivés de son oxyde. Dans presque tous les minéraux contenant du germanium, le germanium est présent sous forme de germanate.
Les Allemands sont appelés les composés hydrogènes du germanium, qui forment une série homologue de différentes molécules à longue chaîne. L'hydrure de monogerman ou germanium (GeH4) est un gaz utilisé dans l'industrie des semi-conducteurs pour l'épitaxie et le dopage.
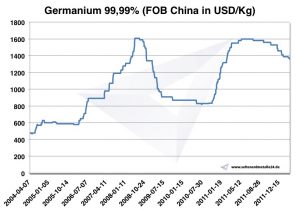
Graphique Germanium 2004-2011

