Magnésium, Mg, numéro atomique 12
Prix du magnésium, historique, occurrence, extraction et utilisation
Le magnésium est un élément chimique dont le symbole est Mg (Alchemy: ⚩) et le numéro atomique 12. Dans le tableau périodique des éléments, il se trouve dans le deuxième groupe principal ou 2. Groupe IUPAC et appartient donc aux métaux alcalino-terreux.
Le magnésium est l'un des dix éléments les plus courants de la croûte terrestre. Il se trouve dans de nombreux minéraux ainsi que dans le vert des feuilles des plantes.
Histoire
L'origine de la désignation de l'élément est indiquée différemment dans la littérature:
- du grec ancien μαγνησα λίθος qui signifie "pierre magnétique",
- Magnisia, une région de l'est de la Grèce,
- de Magnésie, une ville d'Asie Mineure sur le territoire de la Turquie d'aujourd'hui.
Cependant, toutes les dérivations données ici semblent, étymologiquement, provenir des aimants ou de leurs éponymes Heros Magnes.
Les composés de magnésium étaient connus et utilisés pendant des siècles avant la production de magnésium élémentaire. Magnesia alba désignait le carbonate de magnésium, tandis que magnésie était le nom commun de l'oxyde de magnésium.
Le physicien et chimiste écossais Joseph Black était le premier des composés à base de magnésium dans le 18. Siècle systématiquement examiné. 1755 dans son ouvrage De humore acido cibis orto et magnesia alba, il reconnaît la différence entre la chaux (carbonate de calcium) et la magnésie alba (carbonate de magnésium), souvent confondues à cette époque. Il a pris Magnesia alba comme carbonate d'un nouvel élément. Pour cette raison, Black est souvent appelé le découvreur de magnésium, bien qu'il n'ait jamais représenté le magnésium élémentaire.
1808 a obtenu l'hydrure de magnésium magnésium Sir Humphry Davy humidifié par électrolyse à l'aide d'une colonne de cendres Volta - non pas sous forme pure, mais sous forme d'amalgame, puisqu'il travaillait avec une cathode de mercure. Il a donc montré que la magnésie est l'oxyde d'un nouveau métal, qu'il a d'abord appelé Magnium.
En chauffant du chlorure de magnésium sec avec du potassium en tant que réducteur, 1828 a réussi à produire de petites quantités de magnésium pur pour le chimiste français Antoine Bussy. 1833 a été le premier à fabriquer du magnésium par électrolyse de chlorure de magnésium fondu. Sur la base de ces expériences, le chimiste allemand Robert Wilhelm Bunsen a travaillé au cours des années 1840 et 1850 sur des procédés de production de magnésium par électrolyse de sels fondus à l'aide de l'élément de Bunsen qu'il a développé. 1852 a développé une cellule d'électrolyse pour produire de plus grandes quantités de magnésium à partir de chlorure de magnésium anhydre en fusion. Ce procédé est encore préféré aujourd'hui pour la récupération du magnésium.
La production technique de magnésium a commencé 1857 en France après une procédure d'Henri Etienne Sainte-Claire Deville et H. Caron. Dans le procédé dit de Deville-Caron, un mélange de chlorure de magnésium anhydre et de fluorure de calcium est réduit avec du sodium. En Angleterre, Johnson Matthey a commencé à fabriquer 1860 en utilisant un processus similaire. Cependant, en raison de difficultés de fabrication, ces premières entreprises n’ont toujours pas été rentables.
Occurrence
Le magnésium n'existe pas dans la nature en raison de sa réactivité sous forme élémentaire. En tant que minéral, il se présente principalement sous forme de carbonates, de silicates, de chlorures et de sulfates. Sous forme de dolomite, un minéral de magnésium est même propice à la formation de montagnes. B. dans les Dolomites.
Les minéraux les plus importants sont la dolomite CaMg (CO3) 2, la magnésite (bitterspar) MgCO3, l’olivine (Mg, Fe) 2 [SiO4], l’enstatite MgSiO3 et la kiesérite MgSO4 · H2.
Les autres minéraux sont:
- Serpentine Mg3 [Si2O5] (OH) 4
- Talc Mg3 [Si4O10] (OH) 2
- Sepiolite Mg4 [Si6O15] (OH) 2
- Schönit K2Mg (NUMERO SOX) 4 · 2 H6O
- Carnallite KMgCl3 · 6 H2O
- Spinelle MgAl2O4
Lorsqu'il est dissous dans l'eau, il provoque la dureté de l'eau avec le calcium. En eau de mer, il contient plus de 1 kg / m³.
Extraction et présentation
L'extraction du magnésium se produit principalement de deux manières:
- Par électrolyse en fusion du chlorure de magnésium fondu dans les cellules de Downs: Les cellules de Downs sont constituées de grandes cuves en fer chauffées par le dessous. Les anodes servent par dessus des tiges de graphite noyées, qui sont entourées aux extrémités d'une cathode annulaire. Le magnésium métallique s'accumule sur le sel fondu et est écrémé. Le chlore gazeux résultant s’accumule dans la partie supérieure de la cellule et est réutilisé pour produire du chlorure de magnésium à partir d’oxyde de magnésium. Pour abaisser le point de fusion du chlorure de magnésium, du chlorure de calcium et du chlorure de sodium sont ajoutés au sel fondu.
- Par réduction thermique de l'oxyde de magnésium (procédé Pidgeon): Dans un récipient en acier au chrome-nickel, on emplit de la dolomie calcinée, de la baryte et un agent réducteur tel que le ferrosilicium. Il est ensuite évacué (pompé du gaz) et chauffé à 1160 ° C. Le magnésium sous forme de vapeur se condense sur le tuyau d'alimentation refroidi à l'eau à l'extérieur du four. Le magnésium récupéré est ensuite purifié par distillation sous vide.
Le procédé Pidgeon est aujourd'hui le procédé de fabrication le plus important et est principalement utilisé en Chine.
88% de la production mondiale de magnésium a lieu en Chine, où 2015 a produit environ 800.000 t de magnésium métal. Viennent ensuite seulement quelques pour cent de parts de marché en Russie, en Israël et au Kazakhstan.
La production de 1 kg de magnésium par le procédé Pidgeon produit des gaz à effet de serre d’un équivalent CO2 d’environ 31 kg (à titre de comparaison: pour 1 kg d’acier, des équivalents CO0,5 sont formés entre 2 et 2 kg).
Bien que le magnésium soit contenu dans plus de minéraux 60, seules la dolomie, la magnésite, la brucite, la carnallite, le talc et l’olivine ont une importance commerciale.
Le cation Mg2 + est le deuxième cation le plus abondant dans l'eau de mer, rendant l'eau de mer et le sel de mer attrayants comme sources commerciales de magnésium. Pour l'extraire, de l'hydroxyde de calcium est ajouté à l'eau de mer pour former un précipité d'hydroxyde de magnésium.
L'hydroxyde de magnésium (brucite) est insoluble dans l'eau et peut être filtré et mis en réaction avec de l'acide chlorhydrique pour donner du chlorure de magnésium concentré.
L'électrolyse produit du chlorure de magnésium à partir de chlorure de magnésium.
Propriétés
L'alliage de magnésium solide, argenté et brillant est environ un tiers plus léger que l'aluminium. Le magnésium pur a une faible résistance et dureté. Son module concerne le GPa 45. Dans l'air, le magnésium est recouvert d'une couche d'oxyde qui, contrairement à l'aluminium, n'est pas complètement opaque. La raison en est que l'oxyde de magnésium a un volume molaire inférieur au magnésium lui-même (MgO: 10,96 cm3 / mol, Mg: 13,96 cm3 / mol); s. rapport Pilling-Bedworth.
Des bandes minces ou des feuilles sont facilement enflammées. Il brûle dans l'air avec une flamme blanche et brillante en oxyde de magnésium MgO et un peu de nitrure de magnésium Mg3N2. La poudre de magnésium fraîchement préparée peut chauffer dans l'air jusqu'à ce qu'elle s'enflamme spontanément. Des réactions dangereuses sont à prévoir à des températures plus élevées, notamment avec le liquide en fusion. De plus, dans de nombreux oxydes tels que le monoxyde de carbone, l'oxyde d'azote et le dioxyde de soufre, le magnésium est brûlé.
Le magnésium réagit avec l'eau pour former de l'hydrogène:
Réaction du magnésium avec de l'eau
Cela forme un revêtement d'hydroxyde de magnésium faiblement soluble qui stoppe en grande partie la réaction (passivation). Même les acides faibles, tels que les sels d'ammonium, sont suffisants pour dissoudre la couche d'hydroxyde, car ils convertissent les ions hydroxyde en eau et forment des sels solubles. Sans passivation, la réaction exothermique se déroule violemment; plus la poussière de magnésium est fine, plus violente. Avec l'air, l'hydrogène libéré forme facilement un mélange explosif (oxyde d'hydrogène).
Le magnésium réagit de manière exothermique avec le dioxyde de carbone pour former de l'oxyde de magnésium et du carbone:
Réaction du magnésium avec le dioxyde de carbone
Par conséquent, le dioxyde de carbone n'éteint pas les feux de magnésium, mais les alimente.
Il est relativement résistant à l'acide fluorhydrique et aux bases, contrairement à l'aluminium. La raison en est la faible solubilité du fluorure de magnésium (MgF2), qui empêche la formation ultérieure d’ions Mg (OH) 3.
isotope
Il existe un total d'isotopes 21 connus entre 19Mg et 40Mg de magnésium. Trois d'entre eux, les isotopes 24Mg, 25Mg et 26Mg, sont stables et se produisent dans la nature. L'isotope avec la plus grande proportion de la composition isotopique naturelle est 24Mg avec 78,99%, 25Mg a une part de 10,0% et 26Mg de 11,01%. Les isotopes instables dont la durée de vie est la plus longue sont 28Mg, qui se transforme en 20,915Al avec une demi-vie de 28 heures sous désintégration bêta, et 27Mg, qui se désintègre également en 9,435Al avec une demi-vie de 27 minutes sous désintégration bêta. Tous les autres isotopes n'ont qu'une demi-vie de quelques secondes ou millisecondes.
Utiliser
Magnésium métallique
La poudre et le fil de magnésium sont utilisés dans les engins incendiaires, les bombes et les munitions légères, autrefois aussi en poudre flash. Les tiges de magnésium agissent souvent comme des anodes sacrificielles, protégeant de la corrosion des pièces de métaux plus nobles.
Dans la métallurgie, le magnésium trouve une utilisation polyvalente,
- en tant qu'agent réducteur dans le procédé Kroll de récupération du titane,
- en tant qu'agent réducteur pour la récupération d'uranium, de cuivre, de nickel, de chrome et de zirconium,
- comme constituant d'alliages d'aluminium des groupes AlSiMg et AlMg,
- sous forme de granulés de magnésium pour la désulfuration du fer et de l'acier,
- en tant qu'agrégat pour la fonte nodulaire,
- en tant que base d'un groupe d'alliages légers normalisés pour la construction d'aéronefs et de véhicules automobiles (ces masses fondues nécessitent une couche de recouvrement en chlorure de magnésium fondu pour la protection contre la pénétration d'air et l'oxydation, voir Traitement à l'état fondu),
- comme combustible pour les torches qui brûlent sous l'eau.
En chimie organique, il est utilisé pour fabriquer des composés de Grignard.
Comme le magnésium s'enflamme très facilement, il est également utilisé comme briquet très robuste. Ces blocs de magnésium, commercialisés sous le nom de kits de démarrage à l'incendie, comportent d'un côté une tige dont l'abrasion s'enflamme spontanément dans l'air, à la manière du silex d'un briquet. La procédure est très similaire à la méthode de l'âge de pierre consistant à brûler le silex et l'amadou, le magnésium jouant le rôle d'amadou. Premièrement, les copeaux sont grattés du bloc de magnésium avec un couteau et placés sur ou sous le combustible réel. Ensuite, en grattant sur le dos, des "étincelles" (par exemple avec le dos du couteau) génèrent des étincelles aussi proches que possible des tournures de magnésium afin de les enflammer.
les alliages de magnésium
La caractéristique la plus importante des alliages de magnésium, qui les a rendus plus importants que l’aluminium et ses alliages, est la construction légère qu’ils permettent. Avec une densité d'environ 1,75 g / cm³, la différence par rapport à la construction légère en aluminium avec une densité de 2,75 g / cm³ est évidente. De plus, la plage de fusion entre 430 et 630 ° C, c’est-à-dire une économie d’énergie inférieure. Cependant, les propriétés mécaniques telles que la résistance à la traction et la dureté sont nettement inférieures à celles des alliages d'aluminium. La faible densité a rendu le magnésium intéressant pour les applications mobiles dès le début. La première application majeure a eu lieu avant la Première Guerre mondiale dans la construction de l'échafaudage des dirigeables rigides Zeppelin. Dans les automobiles, les alliages de magnésium ont été utilisés pour la fabrication de pièces de boîtier et de jantes pour tous les types d’applications mobiles. Tout cela a conduit à une expansion rapide de la production de magnésium en Allemagne (Elektron de l’usine chimique Griesheim) et après 1930 également aux États-Unis. "Elektron" est devenu le nom de marque des premiers alliages de magnésium immédiatement après le début de la production.
D'autres utilisations de la coulée en magnésium se sont proposées au cours du développement technique, en partie liées à la guerre, en partie constructives et tournées vers l'avenir tout en optimisant les alliages. En tant que matériaux à base de magnésium, les alliages Mg-Al, Mg-Mn, Mg-Si, Mg-Zn et enfin les alliages Mg-Al-Zn ont été développés.
Le carter d’engrenage de la VW Beetle a été coulé en millions de couches d’un alliage Mg-Si. Aujourd'hui, les alliages de magnésium ne sont pas seulement utilisés du point de vue de la réduction de poids, ils se caractérisent également par une atténuation élevée. Cela entraîne une réduction des vibrations et de l'émission de bruit lorsqu'il est soumis à des vibrations. C'est également pour cette raison que les alliages de magnésium sont devenus des matériaux intéressants dans la construction de moteurs, comme dans l'industrie automobile. Ainsi, non seulement certaines parties du moteur sont en alliage de magnésium, mais aussi de plus en plus pour la coulée de blocs moteur, la méthode hybride / coulée hybride est appliquée, pour la première fois en production de masse dans l'Alfa Romeo 156, puis plus tard chez BMW (voir également BMW N52).
Le moulage sous pression (voir également le sous-moulage) peut comporter de nombreux composants, même de grande taille, à paroi mince, proches des dimensions finales, et permet de produire sans retouches coûteuses. En tant que jantes, profils, boîtiers, portes, capots, cache-bagages, levier de frein à main et autres. Non seulement dans l'industrie automobile, mais également dans le secteur de la construction mécanique, des parties en alliage Mg-Al-Zn sont construites.
Les efforts pour une construction légère ont déjà conduit à la fin du 20. Aux alliages magnésium-lithium, même les alliages plus légers de magnésium avec ajout de lithium.
Matériaux de magnésium en médecine
Des recherches récentes promettent un potentiel de développement élevé des matériaux à base de magnésium en tant que matériau d'implant résorbable (par exemple, une endoprothèse) pour le corps humain. Les matériaux à base de magnésium doivent être protégés contre la corrosion par contact lors de l'application. La résistance à la corrosion contre les influences atmosphériques normales est toutefois bonne. Le comportement à la corrosion par contact constituerait un avantage décisif lorsqu’il serait utilisé comme matériau implantaire limité temporairement, car il se dissoudrait en toute sécurité après un certain temps. Cela éliminait les risques et les coûts d'une intervention chirurgicale de retrait d'implant.
engrais
Dans le chaulage des terres arables et des prairies, on utilise à nouveau du magnésium sous forme d'oxyde de magnésium ou de carbonate de magnésium pour compenser l'épuisement en magnésium du sol par les plantes. En outre, le pH du sol est augmenté et la disponibilité d'autres éléments nutritifs est améliorée. Ici, le composé de magnésium est généralement appliqué avec de la chaux comme engrais complexe contenant du magnésium et du calcium. Le phosphate de magnésium Bobierrit, à l'état naturel, Mg3 (PO4) 2 (phosphate de trimagnésium) et le nitrate de magnésium sont utilisés comme engrais complexes.
Physiologie
Le magnésium est l’une des substances essentielles et est donc indispensable à tous les organismes. Dans le vert des feuilles des plantes, la chlorophylle, le magnésium est contenu à environ 2%. Là, il forme l’atome central de la chlorophylle. Les plantes carencées en magnésium hibernent ou manquent de lumière. En outre, le magnésium du corps humain doit être alimenté quotidiennement en quantités suffisantes pour prévenir une carence en magnésium.
Le corps d'un adulte contient environ 20 g de magnésium (à titre de comparaison: 1000 g de calcium). Dans le plasma sanguin, le magnésium est lié à 40% de protéines; le niveau sérique normal est 0,8-1,1 mmol / l. Le magnésium est impliqué dans certaines réactions enzymatiques 300 en tant que constituant d’enzyme ou coenzyme. De plus, les ions Mg libres influencent le potentiel des membranes cellulaires et agissent comme des seconds messagers du système immunitaire. Ils stabilisent le potentiel de repos des cellules musculaires et nerveuses excitables et des cellules du système nerveux autonome. Une carence en magnésium provoque de l’agitation, de la nervosité, de l’irritabilité, un manque de concentration, de la fatigue, une sensation générale de faiblesse, des maux de tête, une arythmie cardiaque et des spasmes musculaires. Il peut aussi arriver à une crise cardiaque. Dans le domaine du métabolisme et de la psyché, une carence en magnésium exacerberait la dépression et la psychose schizophrénique. Un excès de magnésium dans le sang peut survenir à la suite d'un apport excessif et d'un dysfonctionnement rénal et entraîner des troubles du système nerveux et du cœur.
La résorption de magnésium se produit d’abord dans le haut de l’intestin grêle, mais également dans le reste du tube digestif. Il est excrété par les reins et est présent en quantités variables dans tous les aliments, ainsi que dans l'eau de boisson. La dose quotidienne requise d’environ 300 mg est généralement obtenue par le biais d’un régime alimentaire bien équilibré. Un besoin accru peut être couvert par des suppléments ou des médicaments. Une légère carence en magnésium est possible en cas de maladie grave, de grossesse ou de sports de compétition. Des dysfonctionnements rénaux, une diarrhée prolongée, une inflammation intestinale chronique, un diabète sucré mal contrôlé, des corticostéroïdes, certains diurétiques ou un alcoolisme malnutri se manifestent.
Les sels de magnésium tels que citrate, gluconate, aspartate et chlorhydrate d’aspartate sont approuvés en tant que médicaments en doses quotidiennes de 100 à 400 mg contre les carences et les troubles neuromusculaires tels que les spasmes musculaires, la migraine ou la grossesse. Les effets secondaires comprennent l’inconfort gastro-intestinal et la diarrhée, avec surdosage, fatigue et ralentissement du pouls. Les contre-indications comprennent le dysfonctionnement rénal et certaines arythmies cardiaques.
Pour la prise orale de suppléments de magnésium (comprimés, comprimés à mâcher ou pastilles, granules à dissoudre dans un liquide), le dosage est important. Plusieurs études ont conclu que, lors de la prise de 120 mg, environ 35% est absorbé, mais lors de la prise d'une dose quotidienne complète de 360 mg, seulement environ 18% est absorbé. Pour l’absorption dans le corps, la forme des composés utilisés aujourd'hui dans les médicaments n’est pas pertinente, car ils sont équivalents du point de vue pharmacologique, biologique et clinique; Les sels organiques tels que l'aspartate de magnésium ou le citrate de magnésium ne sont absorbés que plus rapidement par l'organisme que les composés inorganiques. D'autre part, le magnésium supplémentaire reste bénéfique dans le corps seulement si suffisamment de molécules de liaison dans le corps sont disponibles; Cela se fait par des ajustements biochimiques uniquement après une augmentation prolongée de l'apport ou de l'absorption de magnésium sur au moins quatre semaines. Le sulfate de magnésium ("sel d'Epsom") était autrefois utilisé comme laxatif. Les sels de magnésium sont utilisés en médecine alternative.
Aliments
Le magnésium sert de cofacteur à diverses protéines 300, notamment des enzymes de liaison à l'ATP et aux acides nucléiques. L'apport quotidien recommandé en magnésium chez l'homme, en fonction de l'âge et du sexe, est compris entre 24 et 400 mg par jour.
Le magnésium est utilisé en tant que composé dans de nombreux aliments, en particulier dans les produits complets (par exemple, pain complet, pâtes complètes, riz complet, flocons d'avoine, corn flakes), eau minérale, notamment eau médicinale, eau du robinet de dureté suffisante, foie, volaille, poisson, graines de citrouille, graines de tournesol, chocolat , Noix de cajou, cacahuètes, pommes de terre, épinards, chou-rave, petits fruits, oranges, bananes, sésame, sirop de betterave à sucre, lait et produits laitiers.
Dangers et mesures de protection
Les dangers du magnésium élémentaire dépendent fortement de la température et de la taille des particules: le magnésium compact est sans danger à des températures inférieures au point de fusion, tandis que les pellicules et les poudres de magnésium sont très inflammables. En raison de la grande surface, ces derniers peuvent facilement réagir avec l'oxygène de l'air. Avec une poudre de magnésium très fine, il existe un risque de combustion spontanée; Les mélanges air-poudre sont même explosifs. La flegmatisation est un traitement réduisant le risque dans le traitement du magnésium, tel que les poudres métalliques en général. Le magnésium fondu s'enflamme aussi spontanément dans l'air. Même avec de nombreuses autres substances, telles que l'eau et d'autres composés contenant de l'oxygène, réagit au magnésium à grain fin ou chauffé. Le magnésium fondu nécessite donc une protection permanente contre la pénétration d'oxygène atmosphérique. En pratique, cela se fait en recouvrant la masse fondue avec des agents riches en chlorure de magnésium. L'hexafluorure de soufre convient également comme protection contre l'oxydation. Le revêtement habituellement habituel avec du soufre élémentaire n’est plus pratiqué en raison des fortes nuisances causées par le dioxyde de soufre.
Dans les incendies de magnésium, les températures peuvent atteindre environ 3000 ° C. En aucun cas, des agents d'extinction courants tels que l'eau, le dioxyde de carbone, la mousse ou l'azote ne peuvent être utilisés, car le magnésium réagit violemment avec ceux-ci. Lorsque l'eau pénètre dans un feu de magnésium, il existe un risque aigu de réaction oxhydrique.
Pour le feu (feux métalliques) d'une masse fondue, le principe d'extinction de la suffocation s'applique, à savoir le déplacement rapide de l'oxygène. Dans le cas le plus simple, recouvrir de sable sec, sinon appliquer un sel couvrant pour les masses de magnésium. La poudre d'extinction de classe de feu D, la poudre de magnésie (magnésie usta / magnésie brûlée), le cas échéant, des éclats de ricin gris et inoxydable sèches conviennent également.
Par conséquent, lors de l'utilisation de magnésium, toutes les instructions de sécurité données doivent être suivies à la lettre. En aucun cas, une atmosphère explosive ne doit être créée (poussière de magnésium, hydrogène, aérosols et vapeurs de lubrifiants de refroidissement combustibles). Les mesures normales de sécurité au travail, telles que la prévention des sources d'inflammation, doivent également être observées.
preuve
La meilleure façon de détecter le magnésium est d'utiliser Magneson II, Titangelb ou Chinalizarin.
Pour la détection avec Magneson II (4- (4-nitrophénylazo) -1-naphtol), la substance mère est dissoute dans de l'eau et alcalinisée. Ensuite, quelques gouttes d'une solution du colorant azoïque Magneson II sont ajoutées. En présence d'ions magnésium, un lac de couleur bleu foncé se forme. Les autres métaux alcalino-terreux doivent être préalablement éliminés par précipitation sous forme de carbonates.
Pour la détection avec Titangelb (Thiazolgelb G), la substance mère est dissoute dans de l'eau et acidifiée. Il est ensuite mélangé avec une goutte de solution de Titangelb et alcalinisé avec une solution diluée d'hydroxyde de sodium. La présence de magnésium produit un précipité rouge vif. Les ions nickel, zinc, manganèse et cobalt interfèrent avec cette détection et devraient tout d'abord être précipités sous forme de sulfures.
Pour la détection avec la quinalizarine, la solution d’échantillon d’acide est mélangée à deux gouttes de la solution de colorant. Ensuite, une solution diluée d'hydroxyde de sodium est ajoutée jusqu'à la réaction basique. Une tache bleue ou un précipité indique le magnésium.
En tant que réaction de détection des sels de magnésium et de la formation de précipités, on peut utiliser des solutions de sels de phosphate. La solution d’échantillon tamponnée exempte de métaux lourds, contenant de l’ammoniac et du chlorure d’ammonium jusqu’à pH 8 à 9, est additionnée de solution d’hydrogénophosphate disodique. Une turbidité blanche, soluble dans l’acide, causée par le phosphate de magnésium et d’ammonium, MgNHXXUMXPO4, indique des ions de magnésium:
À partir d’une solution ammoniacale, Mg2 + peut également être détecté avec l’oxine sous forme de composé jaune-verdâtre peu soluble. Cette épreuve convient au processus de séparation des cations.
Liens
Dans les composés, le magnésium se présente presque exclusivement sous forme de cation divalent à l'état d'oxydation 2.
Oxydes et hydroxydes
L'oxyde de magnésium (magnésie) forme des cristaux incolores dans la structure de chlorure de sodium. Dans la nature, il se présente comme un périclas volcanique. Ils sont blancs à gris, avec des inclusions également vert foncé, des cristaux vitreux brillants. Il est ajouté aux aliments en tant que régulateur de l'acidité ou agent de démoulage et a également diverses applications d'ingénierie dans les laboratoires et dans l'industrie. En médecine, il est utilisé en thérapie de substitution.
L'hydroxyde de magnésium est un sel incolore et fortement basique qui se produit naturellement sous forme de brucite minérale. Il a une structure cristalline trigonale dans le groupe spatial P3m1 (groupe de locaux n ° 164) et est utilisé comme additif pour huile comestible (pour la fixation du dioxyde de soufre), comme floculant pour le traitement des eaux usées, comme retardateur de flamme dans les thermoplastiques (polyoléfines, chlorure de polyvinyle) et comme élastomère et comme additif dans les agents de nettoyage utilisé. En médecine, il est utilisé comme antiacide pour la neutralisation de l'acide gastrique et comme laxatif doux utilisé.
Le peroxyde de magnésium est un composé incolore en poudre fine qui présente une structure cristalline de pyrite dans le groupe d'espace Pa3 (numéro de groupe d'espace 205). Il ressemble au peroxyde de calcium et libère de l'oxygène par réaction contrôlée avec des solutions aqueuses. Il a diverses applications dans l'agriculture, la pharmacie et les cosmétiques.
des halogénures
Le chlorure de magnésium est hautement hygroscopique et se produit naturellement dans l'évêque minéral (MgCl2 · 6 H2O), sous forme de carnallite à double sel (KMgCl3 · 6 H2O), dans l'eau de mer et dans les lacs salés. Il cristallise dans le système cristallin trigonal du groupe d’espaces R3m (numéro de groupe d’espaces 166). En technologie alimentaire, il est utilisé en tant que régulateur d’acidité, consolidateur, exhausteur de goût, excipient ou agent de démoulage. Le chlorure de magnésium hexahydraté, en tant que batterie thermique, peut stocker et libérer de l'énergie thermique.
Le fluorure de magnésium forme des cristaux incolores qui se cristallisent de manière tétragonale dans la structure du rutile dans le groupe spatial P42 / mnm (groupe de nombres d'espace 136). Ses propriétés optiques et sa stabilité chimique en font un matériau important pour les applications optiques.
Le bromure de magnésium et l'iodure de magnésium sont également des sels hygroscopiques qui possèdent une structure cristalline trigonale dans le groupe spatial P3m1 (numéro de groupe spatial 164).
Autres composés inorganiques
Le carbonate de magnésium est présent dans la nature en grande quantité sous forme de magnésite (bitterspar). Il cristallise trigonal dans le groupe d'espace R3c (numéro de groupe d'espace 167). Dans l'industrie alimentaire, il est ajouté en tant que régulateur d'acidité, support ou agent de démoulage. Il est utilisé pour l'escalade et la gymnastique et est également connu sous le nom de magnésie et de craie. Les athlètes se sèchent ensuite eux-mêmes dans les paumes avant de commencer à s’entraîner afin que leur peau ne colle pas trop serrée lorsqu’ils saisissent les barres de barres ou les barres de fer de barres horizontales ou de barres. Il a également des applications médicales et industrielles.
Le nitrate de magnésium est un sel incolore et hygroscopique facilement soluble dans l'eau. L'hexahydrate (Mg (NO3) 2.6 H2O) a une structure cristalline monoclinique avec le groupe d'espace P21 / c (numéro de groupe d'espace 14). Il est utilisé comme engrais, comme accumulateur de chaleur latente (sous forme hexahydratée) ou dans l’industrie de la céramique.
Le sulfate de magnésium heptahydraté (Mg (SO4) · 7 H2O) est connu sous le nom de Mineral Epsomit. Il forme des cristaux incolores qui forment un réseau cristallin rhombique pseudotétragonal. Les cristaux s'épanouissent souvent dans des agrégats fibreux et forment des stalactites. Il est utilisé pour les engrais, comme agent desséchant et pour des applications médicales.
Les phosphates de magnésium (dihydrogénophosphate de magnésium (Mg (H2PO4) 2), hydrogénophosphate de magnésium (MgHPO4) et phosphate de magnésium (Mg3 (PO4) 2)) sont utilisés dans l'industrie en tant que matière première céramique et agent ignifuge. Dans l'industrie alimentaire, ils sont utilisés en tant qu'additif alimentaire, laxatif et additif alimentaire. Les aliments sont ajoutés en tant que régulateur d'acidité ou agent de libération.
Le spinelle est un minéral fréquent de la classe minérale des oxydes et des hydroxydes avec la composition chimique idéalisée MgAl2O4 et est donc chimiquement un aluminate de magnésium. Il se cristallise de manière isotypique avec la magnétite dans le système cristallin cubique du groupe spatial Fd3m (numéro de groupe spatial 227).
La dolomite est un minéral très commun de la classe minérale des carbonates et des nitrates, de composition chimique CaMg [CO3] 2. Il s’agit donc d’un carbonate de calcium-magnésium. Il cristallise dans le système cristallin trigonal du groupe d'espace R3 (numéro de groupe d'espace 148).
L'hydrure de magnésium peut être utilisé comme hydrogène et comme stockage d'énergie. L'hydrogène libéré par l'hydrure de magnésium peut produire une mousse métallique aux propriétés intéressantes, plus légère que l'eau.
D'autres composés de magnésium cristallins intéressants incluent, par exemple, le diborure de magnésium, le carbure de magnésium, le nitrure de magnésium, le sulfure de magnésium, le siliciure de magnésium, le germanure de magnésium, le métasilicate de magnésium, l'oxyde de magnésium titane et le polonure de magnésium.
organomagnésien
Les organyles de magnésium sont des composés organométalliques dans lesquels il existe une liaison entre le magnésium et le carbone. Parmi les organomagnésiens, les composés de Grignard (R-Mg-X) sont de loin les plus importants. Les organyles de magnésium binaires et les halogénures d'alcénylmagnésium jouent un rôle nettement subordonné.
Organylmagnesiumhalogenide
Les halogénures d'organylmagnésium (généralement appelés composés de Grignard) sont obtenus directement par la réaction d'halogénures d'organyle avec des tournures de magnésium. Les composés de Grignard sont en solution à l'équilibre de Schlenk. Ils réagissent sous la substitution halogène-organyle aux organyles élémentaires:
Général:
z. Par exemple:
ou par addition d'organyles avec plusieurs systèmes de liaison:
Général:
z. B.:
Des organyles binaires de magnésium (R2Mg, également appelés diorganyles de magnésium) peuvent être produits de différentes manières:
par transmétallisation, par exemple du mercure diorganylène:
par dismutation dans le décalage de l'équilibre de Schlenk à l'aide de 1,4-dioxane:
Des magnésiumacycles (alcanes cycliques avec un cycle de magnésium) peuvent également être préparés avec 1,4 dioxane.
par métathèse de composés de Grignard avec des organyles de lithium
par hydromagnétisation (addition de MgH2 aux alcènes 1):
par addition de doubles liaisons C = C au magnésium élémentaire dans certains hydrocarbures insaturés tels que le 1,3-butadiène ou l'anthrracène (addition de métal). Par exemple, la réaction de 1,3-butadiène dans le tétrahydrofurane à la température ambiante est possible:

Le magnésium butadiène produit, également appelé (2-butène-1,4-diyl) magnésium, peut servir de source d’anions butadiène dans les synthèses ultérieures. De même, le magnésium anthracène jaune orangé est présenté. Le magnésium anthracène peut ensuite être utilisé comme catalyseur pour l'hydrogénation du magnésium.
alkenylmagnesium
Les alcynes réagissent avec les alcènes pour donner des halogénures d’alcénylmagnésium au cours de la carbomagnétisation:

Autres composés organiques
Le citrate d'hydrogène et le dicitrate de magnésium sont des sels de magnésium de l'acide citrique. Le citrate de magnésium est utilisé comme médicament.
Le monoperoxyphtalate de magnésium est un désinfectant pour la désinfection de surface.
Le stéarate de magnésium est le sel de magnésium de l'acide stéarique et appartient aux savons à la chaux. Il se compose d'un ion magnésium et de deux ions stéarate à longue chaîne.
Prix du magnésium
Prix du magnésium -> prix des métaux stratégiques
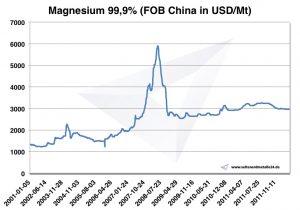
Graphique Magnésium 2001-2011













